Seminario 1
Noviembre - 2020
Anemia del prematuro: fierro y acido fólico.
Objetivos de la presentación
Definición y Generalidades
Homeostasis del Fierro
Porqué es importante el fierro ? Fierro y cerebro
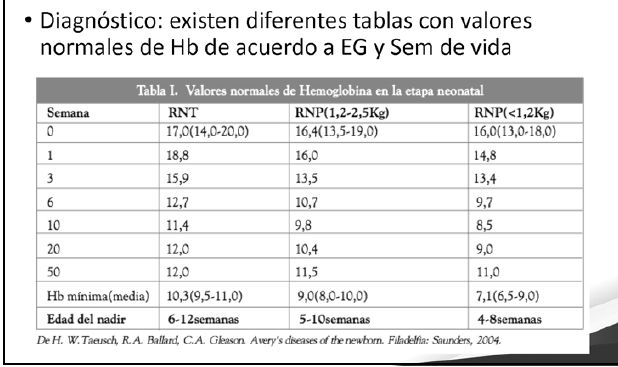
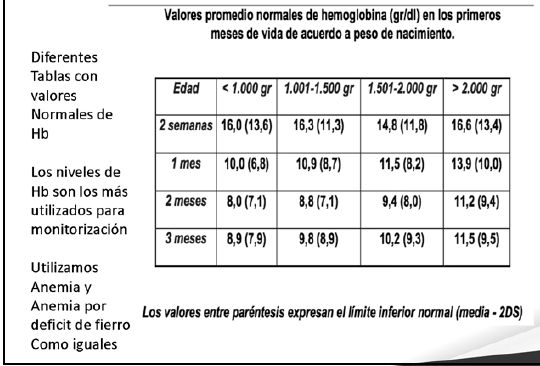
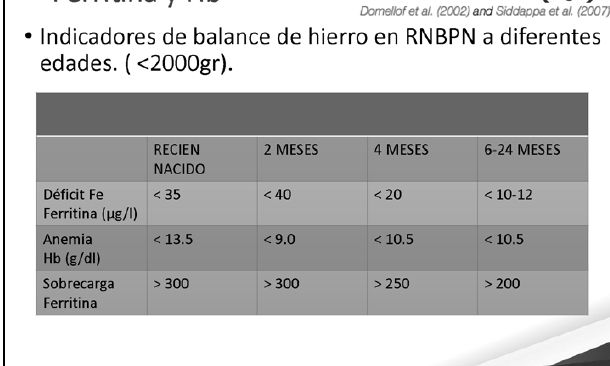
Diagnóstico y monitorización del estado de Hierro
Prevención y Suplementación
Acido fólico ¿ es necesario ?
Anemia del prematuro (AP): Introducción
Es una de las morbilidades más frecuentes presentes en los RNPT
La AP es una forma exagerada de la "anemia fisiológica" del lactante que se manifiesta por una caída en los valores de hemoglobina entre las 10 y 12 sem de vida pudiendo llegar a 10 - 12 gr/dl de Hb.
Es más frecuente en RNPT de muy bajo peso de nacimiento.
En menores 32 s y/o menores 1500 grs alcanza 25 - 85 % de Prevalencia
Es más precoz y exagerada
Se presenta entre las 4 y 6 semanas de vida
Es más severa a menor EG y menor PN.
Puede llegar a 7 - 8 grs /dl de Hb
Los menores de 28 s y menores 1000 grs requieren Transfusión de GR incluso en primera semana de vida y más de 1 transfusión
Es MULTIFACTORIAL :
Bajas reservas de fierro al nacer.
El 66 % de la transferencia de Hierro desde la madre al feto ocurre en el tercer trimestre del embarazo.
Esta transferencia y reservas de hierro están afectadas en todas las patologías asociadas a Insuficiencia Placentaria (madres con trastornos hipertensivos del embarzo, retraso crecimiento intrauterino, embarazos gemelares , diabetes gestacional, etc).
Rápido crecimiento de estops prematuros con expansión de su volumen extracelular grande entre las 4 y 6 semanas de vida que es lo conocido como catch up, que es un período con alta necesidad de eritropoyesis y por tanto riesgo de presentar anemia.
Corta sobrevida del GR fetal.
Tienen vida media mucho más corta que la del adulto dado sus características de membranas que los hacen más flexibles pero con vida media más corta.
Baja producción y actividad de la eritropoyetina (Epo)
La Epo es la principal hormona estimulante de la eritropoyesis que se activa en respuesta a la Hipoxia.
En estos prematuros su nivel de activación es bajo es o sea requiere niveles de hipoxia mucho más alto y se produce en menor cantidad
Pérdidas por toma de exámenes
Características
Anemia normocítica - normocrómica por definición asociada a déficit de Hierro.
En general la sintomatología aparece con valores de Hb bajo 7-8 g/dl, y estaría dada por una reducida entrega tisular de 02.
Hay otras causas en estos prematuros con menor entrega tisular de O2 como distrés respiratorio, sepsis, etc
Síntomatología : taquicardia, taquipnea, apneas, actividad motora disminuída, dificultad en alimentación, ganancia insuficiente de peso, elevación del lactato plasmático, bajo valor C-rS02 NIRS. (saturación cerebral regional)
Sin embargo no hay correlación entre niveles de Hb y síntomas.
Anemia del Prematuro está asociada a retraso del desarrollo a largo plazo, que puede ser irreversible si no es tratada en períodos de ventana vulnerables.
A diferencia de RNT en PT suelen predominar las alteraciones motoras versus cognitivas .
Homeostasis del Hierro
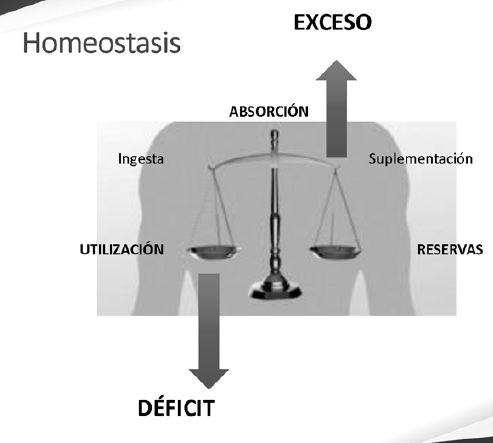
Balance de Hierro en el organismo.
Podemos tener 2 situaciones :
Déficit : lleva a Anemia
Exceso
Debe haber equilibrio entre:
Utilización
Absorción
Reservas
Va a influir :
Ingesta
Suplementación
Transfusión G.R.
Homeostasis del Hierro
El hierro es un nutriente esencia l para el ser humano.
En soluciones acuosas se encuentra en 2 estados de oxidación estables: Ferroso ( Fe2+) y Férrico ( Fe+3).
Estas 2 formas participan en múltiples procesos bioquímicos : rutas bioenergéticas anivel celular (mitocondrial), síntesis de ADN, aporte de 02 cuando está unido a Hemoglobina.
Se deben unir a proteínas por ser metal oxidante (en contacto con O2 se oxida y produce daño por oxidación ) : Transferrina (transporte) y Ferritina ( proteína reserva).
Otras Hemoproteínas: cofactor enzimático (oxidasas, catalasas, peroxidasas), transferencia electrones ( citocromos), transporte de 02 ( hemoglobina).
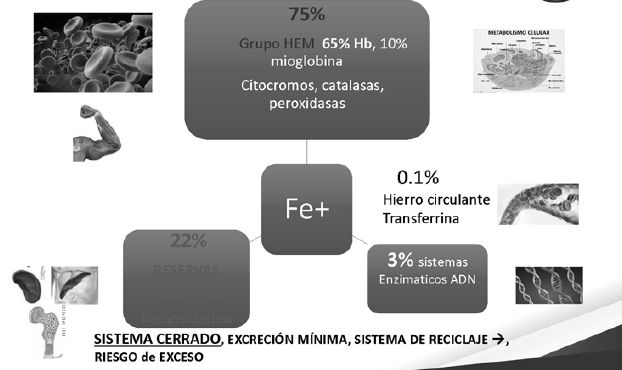
Contenido y distreibución del Hierro corporal
75 % está formando parte de Grupo HEM de glóbulos rojos
65 % Hemoglobina
10 % Mioglobina
Engranaje del Metabolismo celular (citocromos, oxalasas y peroxidasas)
22 % en forma de reserva
Unido a Ferritina en hígado, bazo y médula ósea.
Hemosiderina
0.1 % Hierro circulante unido a Transferrina
3 % forma parte de sistemas enzimáticos de síntesis de ADN
Es un sistema cerrado sin que exista un órgano excretor de hierro
Su excreción es mínima por la descamación celular, la descamación y pérdida de enterocitos
Es uno de los sistemas del organismo más importantes de reciclaje.
El hierro en el organismo va circulando y se va reutilizando y de ahí el riesgo de exceso de Hierro.
Absorción y transporte del Hierro
Absorción se produce principalmente en duodeno.
Hierro dietario puede estar en estado férrico (alimentos como verduras o medicamentos) o hierro hémico (carnes rojas).
Este último es el absorbido con mayor eficacia.
Las soluciones farmacológicas vienen como sal ferrosa.
Ambos iones ferroso y férrico se presentan ante los enterocitos y son capaces de ser absorbidos .
20 - 30 % del hierro detario en forma de grupos HEM es absorbido
Sólo 10 % de hierro férrico dietario es absorbido
La solución de hierro es soluble a pH ácido (< 3)
En estados de ferropenia la capacidad absortiva del hierro se puede ver aumentada hasta en 3 - 4 veces
La leche de vaca, oxalatos, fibras, fitatos, hipo y aclorhidria disminuyen la absorción de hierro a nivel intestinal.
Esto último es importante en pacientes en que se usan inhibidores de bomba de protones como antiácidos lo que disminuye la absorción de hierro.

Mecanismos de absorción del hierro y regulación
Grandes avances en los últimos años, entendiendo regulación compleja que puede llevar a déficit o sobrecarga de hierro.
La regulación hacia la baja de absorción es inmadura y madura gradualmente hasta los 9 meses, por lo tanto aún teniendo adecuadas reservas puede existir riesgo de exceso.
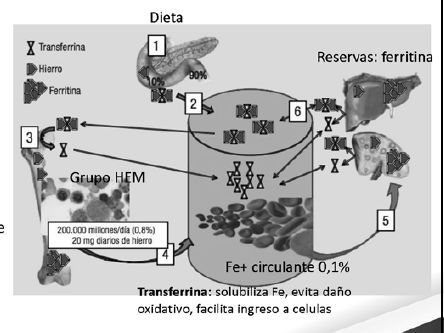
El hemo o grupo HEM es liberado de Hemoglobina y Mioglobina por Enzimas pancreáticas y forman metaloporfirina que vuelve a circulación y su Hierro es reutilizado.
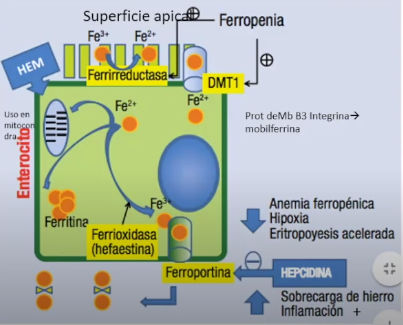
En figura hay un Enterocito con parte superior Apical y la inferior Basal que se va a comunicar con la circulación.
En la superficie apical tenemos :
Ferrireductasa que transforma el Hierro férrico en Hierro ferroso
DMT1 que es transportador bivalente de metales
La expresión del gen de esta proteína es estimulada por la Ferropenia
El exceso de hierro puede disminuir la expresión de este transpotador.
Este transportador tambien se usa en absorción de cobre, zinc y selenio.
Después del ingreso al enterocito puede ir a participar de actividades bioquímicas a nivel mitocondrial, unirse a la proteína transportadora Ferritina o pasar a la circulación a gtravés de otro transportador : Ferroportina. ubicado en la superficie basal del enterocito.
La ferroportina está regulada por la Hepcidina que es una hormona sintetizada a nivel hepático y que cuando está activa inhibe la acción de la Ferroportina o sea disminuye la absorción de Hierro.
En caso de anemia, hipoxia o eritropoyesis muy acelerada la Hepcidina es inhibida y aumenta la actividad de la Ferroportina y aumenta la absorción de hierro.
En caso de sobrecarga de hierro o procesos inflamatorios crónicos se estimula la Hepcidina y se disminuye la capacidad absortiva de hierro..
Entrada de grupo HEM sin transportador.
Metabolismo férrico
REGULACIÓN:
Disponibilidad de hierro divalente ( Fe3e+ ==> Fe2+)
Reservas unido a Ferritina en Bazo e Hígado
Grupo Hem
Actividad y expresión de la DMTl,
Actividad y expresión de la hepcidina, que inhibe Ferroportinas, y está estimulada por procesos inflamatorios y sobrecarga de hierro e inhibida en anemia ferropénica, hipoxia, eritropoyesis aumentada.
En organismo adulto se cambia el 0.8 % de masa eritrocitaria diariamente y ésto aporta 20 mg diarios de hierro elemental.
Importancia del Fe : Hierro y Cerebro
Déficit de fierro en prematuros afecta a la mayoría de los órganos, pobre crecimiento pondoestatural , inestabilidad térmica, disfunción tiroidea, disminución respuesta inmune celular, alteración síntesis de colágeno y de ADN.
Sin embargo la mayor preocupación está dada por sus efectos en el neurodesarrollo y su impacto en el desarrollo cerebral.
Anemia Prematuro asociada a alteraciones en desarrollo motor , cognitivo, social y conductual a corto y largo plazo.
El Hierro forma parte del metabolismo cerebral :
Impacto cerebral: Fe cofactor enzimático que participa en síntesis de neurotransmisores, mielinización, sinaptogénesis, expresión génica (epigenética) y producción energética cerebral.
Tanto la duración y el momento en que ocurre el déficit son cruciales, incluso en caso de ausencia de anemia (influye solo el déficit de Hierro).
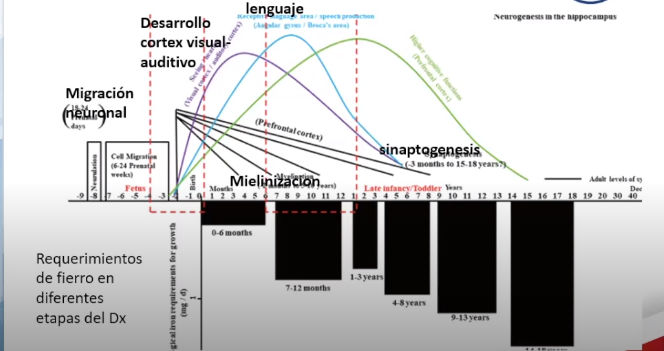
Hierro y Desarrollo Cerebral
En parte superior se ven diferentes períodos del desarrollo cerebral.
Etapa de migración neuronal entre 6 y 24 semanas de gestación
Desarrollo cortex visual - auditivo
Mielinización sobre todo de zonas de lenguaje
En parte inferior se ven los requerimientos de hierro en las diferentes etapas del desarrollo
Entre los 7 y 12 meses aumentan por la gran mielinización
Después son altos en adolescencia y Embarazo
Los prematuros se ven expuestos a estrés oxidativo en múltiples ocasiones
Estrés oxidativo : el Fe tiene capacidad oxidativa
En el prematuro en múltiples etapas de su vida desde el nacimiento está enfrentado a estrés oxidativo :
Al nacer
O2 en RCP
Asfixia
Hipoxia
Hiperoxia
Sepsis, etc
Todo lo anterior puede llevar a necrosis neuronal, estrés oxidativo y apoptosis.
El estrés oxidativo está asociado a otras morbilidades neonatales como DBP, HIV. HIV y leucomalacia periventricular.
Este mismo fenómeno puede tambien ocurrir a nivel cerebral.

No sólo el déficit es un problema ... qué pasa con exceso de hierro y el cerebro ?
A nivel neuronal y de las glías tambien esta presente el transportador DMT -1
El hierro participa en múltiples actividades a nivel neuronal tanto a nivel bioquímico - energético como en síntesis de mielina.
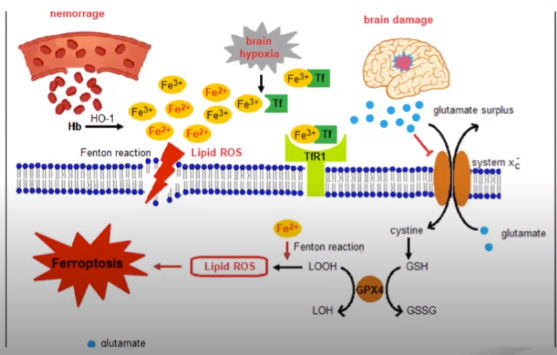
En Hemorragia IV hay salida de grupos Hem que van a procesos enzimáticos con liberación de Fe que va a producir daño a nivel celular en células ependimarias, en células de microglia aumentando liberación de radicales libres de oxígeno.
Esto nos puede llamar a apoptosis asociada a Hierro o Ferroptosis.

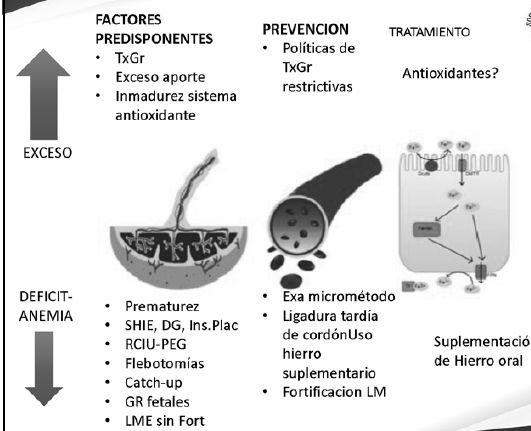
Riesgo de exceso de Hierro en Prematuros
Por ejemplo en caso de transfusiones repetidas
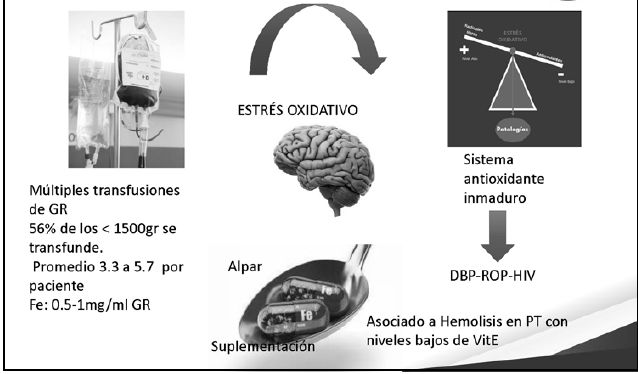
Un 56 % de los menores de 1.500 grs se transfunde.
80 - 90 % de los menores de 1000 grs
Reciben su primera transfusión en la primera semana más del 50 % de estos prematuros
En promedio reciben 3.3 a 5.7 transfusiones por paciente.
Aportan 0.5 - 1 mg / ml de GR transfundido de Fe.
Son niños con sistema antioxidante inmaduro en que hay desbalance entre antioxidantes y cantidad de radicales libres producidos con lo cual hay mayor riesgo de DBP-ROP-HIV y ferroptosis
Los niños que reciben suplementación por vía enteral además presentan niveles bajos de Vitamina E que es antioxidante por lo cual tienen mayor riesgo de presentar Hemólisis y ruptura de GR..
Mecanismo de daño por ferroptosis
La hemorragia intraventricular, la hipoxia cerebral pueden producir daño cerebral por activación del transportador Glutamato produciendo gran nivel de glutamato hacia el extracelular con disminución de Cistina y activación de cascada inflamatoria a nivel lipídico produciendo ruptura de mielina, células neuronales y glía .
Toxicidad por hierro : Resumen
RNPT altamente vulnerables a daño por estrés oxidativo.
Múltiples morbilidades de la prematurez asociada a estrés oxidativo: DBP, ROP, LMPV, HIC.
Daño por hierro: Ferroptosis.
Riesgo en PT poiitransfundidos.
Estudios muestran relación entre número de Transfusiones de Gr y DBP - ROP.
No sólo afección Cerebro, también en sistema inmune, crecimiento, interferencia con absorción de cobre, zinc, molibdeno que compiten por el mismo transportador.
Alteración de la microbíota intestinal con aumento bacterias patógenas y provocando estado proinflamatorio.
Riesgo de hemólisis en caso de déficit de Vit E.