Rubéola
Febrero 2018
Rubéola
9.- Diagnóstico de laboratorio del sarampión y la rubéola
La detección de la IgM específica del sarampión o la rubéola en el suero es la prueba estándar para el diagnóstico rápido de estas enfermedades en el laboratorio. La prueba de IgM se realiza en general usando kits comerciales de ensayo inmunoenzimático. Algunas pruebas comerciales de IgM del sarampión y la rubéola aplican un método indirecto. Este método requiere el bloqueo de los anticuerpos de tipo IgG y del factor reumatoideo mediante un tratamiento previo, con lo cual obtiene un rendimiento óptimo.
En el diagnóstico del sarampión y la rubéola se han desarrollado ensayos basados en la captura de IgM. Estas pruebas no requieren la remoción de los anticuerpos IgG, y se consideran un poco más específicas y técnicamente más sencillas de realizar, que los ensayos inmunoenzimáticos indirectos de detección de anticuerpos de tipo IgM.
En este capítulo se describen las pruebas indirectas y los ensayos de captura.
La detección de un aumento de la IgG específica en muestras séricas recogidas durante la fase aguda y de convalecencia ya no se utiliza en forma rutinaria en el diagnóstico de la infección aguda por los virus del sarampión y la rubéola, pero se puede usar con el propósito de confirmar la infección. Las pruebas de IgG implican la obtención de dos muestras, con un intervalo de 10 a 30 días y también se pueden utilizar en la confirmación de casos esporádicos con resultados de IgM positivos o dudosos en países que se encuentran en la fase de eliminación. En los estudios de seroprevalencia, realizados como apoyo a las actividades de control del sarampión y la rubéola, se realiza en forma característica la detección cuantitativa de IgG mediante ensayo inmunoenzimático en una muestra única de suero.
Los sistemas de detección directa del sarampión y la rubéola mediante RCP-TR se están generalizando pero, aunque se han establecido métodos estandarizados, todavía no se ha definido un protocolo único. Los métodos bien definidos y ampliamente utilizados en la detección del sarampión por RCP-TR elaborados por los CDC en Atlanta (Estados Unidos) y por el Organismo de Protección Sanitaria en Londres (Reino Unido) son accesibles a quienes los soliciten a la OMS o a los laboratorios correspondientes.
Aunque no se recomienda en el diagnóstico rutinario de laboratorio, el cultivo de los virus del sarampión y de la rubéola a partir de muestras clínicas sí constituye un componente importante de las estrategias de control del sarampión y la rubéola. En el anexo 9.4.7 se presentan los procedimientos de aislamiento de virus de cultivos celulares.
Pruebas de IgM
ELISA de captura de IgM
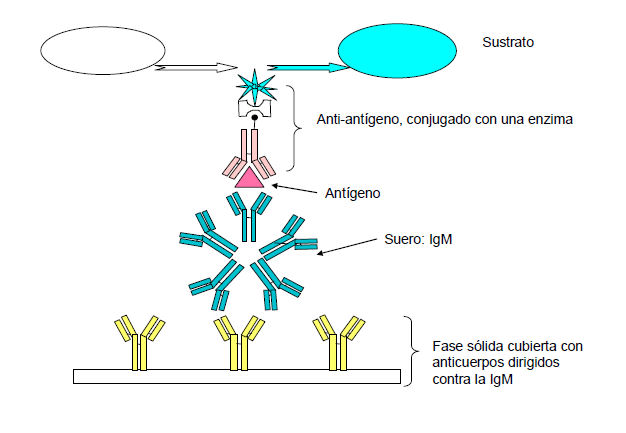
En el ensayo inmunoenzimático de captura de IgM (figura 8) , el anticuerpo de tipo IgM en el suero del paciente se une al anticuerpo dirigido contra la IgM humana adsorbido sobre una fase sólida. Esta etapa no es específica del virus.
Luego, se lava la placa a fin de extraer otras inmunoglobulinas y proteínas séricas. Enseguida se agrega el antígeno viral y se permite que se una a todas las IgM presentes, específicas del virus.
Después de lavar, se detecta el antígeno fijado mediante un anticuerpo monoclonal dirigido contra el virus, conjugado a una enzima; a continuación, se revela la presencia o ausencia de IgM específica del virus en la muestra, gracias a un sistema de detección con sustrato cromógeno.
Diagrama de la prueba ELISA de captura de IgM

Ensayo inmunoenzimático indirecto de IgM específica del virus
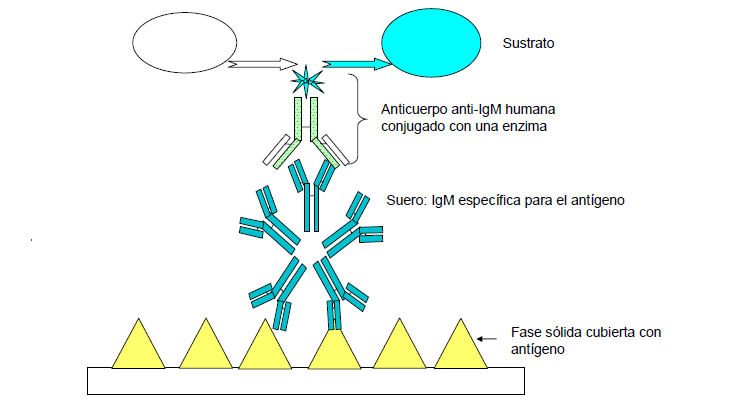
En el ensayo inmunoenzimático indirecto de IgM (figura 9 ), se utiliza un absorbente del factor reumatoideo en una etapa previa al tratamiento, a fin de formar complejos con los anticuerpos IgG de los sueros que se han de analizar.
El primer paso de absorción del antígeno viral sobre la fase sólida suele completarlo el fabricante y lo suministra listo para el uso. Se agrega luego el suero del paciente y entonces, todos los anticuerpos específicos contra el virus (IgM y todas las IgG no absorbidas) se unen al antígeno.
El anticuerpo de tipo IgM se detecta directamente por medio de un anticuerpo monoclonal dirigido contra la IgM humana, marcado con una enzima
o indirectamente por medio de un anticuerpo monoclonal dirigido contra la IgM humana, más un anticuerpo antirratón marcado con una enzima.
Se agrega un sustrato cromógeno con el fin de revelar la presencia de IgM específicas del virus en la muestra que se analiza.
Figura 9.- Diagrama de la prueba ELISA indirecta de IgM (Suero preabsorbido a fin de extraer la IgG y el factor reumatoideo)
Interpretación de los resultados de la prueba de IgM en pacientes con antecedente de vacunación reciente
Dado que la vacunación con la vacuna combinada contra la rubéola y el sarampión y con la triple viral estimula las respuestas específicas de IgM contra el sarampión y contra la rubéola, el antecedente de vacunación con una de las dos hasta seis semanas antes del comienzo del exantema dificulta la interpretación de los resultados de las pruebas serológicas.
En un estudio randomizado de doble ciego de 581 pares de gemelos, de 460 niños entre 14 y 18 meses de edad, 32% presentaron fiebre moderada o alta después de la vacuna triple viral (comparados con 9% de quienes recibieron placebo; p < 0,002), con una incidencia máxima entre 9 y 10 días después de la inyección. Entre el noveno y el décimo días también fueron más frecuentes en los niños vacunados que en aquellos que recibieron placebo, signos como irritabilidad (7,3% contra 4,0% en quienes recibieron placebo), somnolencia (3,5% contra 1,4%) y exantema (4,3% contra 3,0%),.
Las pruebas serológicas no permiten establecer la diferencia entre la respuesta inmunitaria a la infección natural y a la vacunación; esto sólo se puede conseguir con el aislamiento viral y su caracterización. Además, estudios realizados en Europa revelaron que los parvovirus B19, los enterovirus, los adenovirus, el herpes virus humano de tipo 6 y los estreptococos de grupos A y C son los patógenos que causan con mayor frecuencia las enfermedades exantemáticas febriles y representan de un ercio a la mitad de todos los casos .
En ambientes tropicales, cerca de un tercio de infecciones primarias por el virus del dengue puede comportar erupciones cutáneas y fiebre y este virus es la causa de la gran mayoría de casos de exantema y fiebre observados en períodos epidémicos de dengue. En estas circunstancias, es posible que entre los casos de exantema febril causados por otros patógenos se encuentren personas que han recibido recientemente la vacuna combinada contra la rubéola y el sarampión o la triple viral y que una respuesta de IgM provocada por la vacuna se atribuya erróneamente a una infección por el virus del sarampión o de la rubéola.
Por consiguiente, se recomienda que en los casos con IgM positiva y antecedente de vacunación antisarampionosa, antirrubeólica o ambas entre 1 y 6 semanas antes de la aparición del exantema, el diagnóstico de infección se elimine después de una investigación epidemiológica minuciosa, que no ponga en evidencia pruebas de otros casos confirmados en los alrededores ni de un vínculo epidemiológico con casos confirmados.
Los países en la fase de eliminación deben considerar la posibilidad de realizar (según convenga) las pruebas de dengue, parvovirus B19 y herpes virus humano de tipo 6 como parte del diagnóstico diferencial de todos los casos con resultados positivos de IgM de sarampión y rubéola.
Interpretación de los resultados de muestras con pruebas de IgM positivas simultáneamente para sarampión y rubéola
Las concentraciones de IgM específicas en respuesta a la infección y a la vacunación con el virus del sarampión y la rubéola, suelen disminuir por debajo del umbral de detección en 1 a 2 meses [49]. Además, en pacientes infectados por otros virus, en particular el Epstein-Barr pueden ocurrir respuestas de anticuerpos IgM heterotípicos y los sueros de estos pacientes pueden dar resultados falsos positivos de IgM de sarampión, de rubéola o de ambos . Estos factores hacen muy difícil la interpretación de la detección de IgM específicas de sarampión y rubéola cuando no existen síntomas clínicos claros, sobre todo en países con baja incidencia. En estos casos, pueden ser útiles en la interpretación las pruebas confirmatorias, como la RCP-TR, el aislamiento positivo del virus, el aumento al cuádruple de los títulos de IgG en muestras séricas de fase aguda y de convalecencia o la prueba de avidez de la IgG.
Pruebas de anticuerpos de tipo IgG
El uso de la detección de IgG a fin de confirmar una infección reciente requiere el análisis en paralelo de dos muestras de suero obtenidas con un intervalo mínimo de 10 días.
Dado que a menudo puede ser difícil obtener la segunda muestra, se recomiendan las pruebas de IgM con muestra única. Sin embargo, cuando los resultados del análisis no son concluyentes, se puede recoger otra muestra sérica (fase de convalecencia) entre 10 y 30 días después de la primera muestra (fase aguda), con el objeto de determinar un aumento del título de IgG. Sin embargo, la primera muestra sérica se debe obtener en los 10 primeros días de iniciado el exantema y la prueba de IgG para confirmación por laboratorio requiere la demostración de un aumento al cuádruple del título del anticuerpo contra el sarampión o la rubéola.
Las pruebas diagnósticas de IgG se deben realizar en forma simultánea con muestras de período agudo y de período de convalecencia, aplicando el mismo tipo de prueba. Los criterios específicos que confirman un aumento del valor dependen de cada prueba. Los valores de densidad óptica de los ensayos inmunoenzimáticos no corresponden a los títulos y su incremento no equivale directamente al aumento de los mismos.
Los ensayos más ampliamente utilizados en la detección de anticuerpos IgG contra el sarampión y la rubéola son los ensayos indirectos. En estos análisis, el antígeno viral purificado se adsorbe sobre una fase sólida y luego se agrega el suero del paciente. Todo anticuerpo específico del virus se une al antígeno y las IgG específicas del virus se ponen en evidencia gracias a una IgG antihumana. La unión de la IgG específica del virus se mide mediante un sistema de detección directa o indirecta por intermedio de un sustrato cromógeno.
Prueba de avidez de la IgG
La avidez de un anticuerpo se refiere a la fuerza de la interacción del anticuerpo con un antígeno polivalente. Según la fuerza de esta unión, el complejo formado se disocia con mayor o menor facilidad. La avidez del anticuerpo es baja después del contacto primario con el antígeno, se fortalece con el tiempo y en general hace intervenir anticuerpos de tipo IgG . Los ensayos que miden la avidez de la unión del antígeno a los anticuerpos IgG se han concebido con el fin de diferenciar los anticuerpos de baja afinidad, producidos durante la fase inicial de la infección, de aquellos con una unión de alta afinidad que reflejan una inmunidad pasada. Las pruebas de avidez de IgG pueden ayudar a diferenciar las infecciones primarias y secundarias por el virus de la rubéola y a excluir la posibilidad de IgM residual, meses o años después de la infección primaria. Sin embargo, los análisis de avidez de IgG son difíciles de implementar, de estandarizar y de interpretar, es difícil su control de calidad y se recomiendan sólo en los laboratorios con experiencia en este tipo de ensayos. La OMS pone a la disposición de los interesados que lo soliciten la lista de laboratorios con pericia en la realización de análisis de avidez de IgG para confirmación de la infección por el virus de la rubéola.
Reacción en cadena de la polimerasa con transcripción reversa
La función más importante de la RCP-TR en el control del sarampión y la rubéola reside en la caracterización genética de los virus salvajes causantes y la detección de variación genómica en diferentes momentos y regiones del mundo. Dado que la RCP-TR puede detectar partículas virales inactivadas, el lapso de detección del virus, después de la aparición del exantema, suele ser varios días más prolongado que el lapso del aislamiento viral.
Sin embargo, la RCP-TR presenta algunos problemas técnicos relacionados con la sensibilidad y reproducibilidad que pueden invalidar el análisis. Además, la contaminación cruzada durante la RCP- R constituye un problema importante, a menos que se establezcan y se mantengan las más estrictas normas de laboratorio. Por estas razones no se recomienda que los laboratorios realicen pruebas de RCP, a menos que cuenten con espacios especiales designados para cada uno de de los procedimientos de la prueba y con personal que haya recibido una capacitación exhaustiva.