Dilatación ventricular posthemorrágica
Febrero 2018
Umbrales de tratamiento para la intervención en la dilatación ventricular poshemorrágica: un ensayo controlado randomizado
Linda S de Vries Department of Neonatology , Wilhelmina Children’s Hospital, Utrecht, The Netherlands
Arch Dis Child Fetal Neonatal Ed 2018;0:F1–F6. doi:10.1136/archdischild-2017-314206
Introducción
Aunque la incidencia de hemorragia intraventricular - matriz germinal (GMH-IVH) en recién nacidos de muy bajo peso al nacer disminuyó en los años 90, no ha disminuído más en la última década. Los RN con hemorragia de grado III y IV, 1 especialmente aquellos que desarrollan dilatación ventricular poshemorrágica (PHVD), tienen mayor riesgo de desarrollar secuelas neurológicas. La PHVD ocurre en aproximadamente 30% -50% de los niños con GMH-IVH grave y existe una discusión en curso sobre el mejor momento para intervenir.2-4
Debido al alto contenido de agua de la
materia blanca inmadura y al gran espacio extracerebral en prematuros extremos,
los síntomas y los signos de presión intracraneal elevada se desarrollan varias
semanas después del inicio de la PHVD. Esto permite un aumento considerable en
el tamaño del ventrículo sin afectar la presión de la fontanela o la
circunferencia cerebral. 5
Se ha reportado en neonatos con PHVD progresiva, deterioro de la actividad basal
de la electroencefalografía (EEG), latencia aumentada de potenciales evocados,
aumento del índice de resistencia Doppler y oxigenación cerebral disminuída ,
6-11 todas las cuales mostraron mejoría una semana después de
la intervención neuroquirúrgica.
La ecografía craneal (cUS) se utiliza para seguir el progreso de la DPH y el "índice ventricular" (VI) se utiliza con mayor frecuencia.12 La mayoría de los estudios de intervención han tomado el percentil 97 (p97) + 4 mm como punto de partida para randomización.13 -15 Otras medidas útiles son el ancho del cuerno anterior (AHW) y la distancia tálamo-occipital (DOT) .16,17
En estudios retrospectivos previos, la
intervención muy temprana, antes del desarrollo de los síntomas clínicos y antes
de la dilatación severa de los ventrículos laterales, se asoció con menor
necesidad de derivación ventriculoperitoneal (VP) y con mejor resultado del
desarrollo neurológico.2,3,18
Nuestro objetivo fue probar la hipótesis de que la intervención muy temprana,
antes de cruzar la línea p97 + 4 mm, reduce la muerte y / o la necesidad de
derivación VP en comparación con la intervención mas tardía.
Pacientes y métodos
Niños del estudio
Los niños enrolados nacieron entre julio de 2006 y julio de 2016 e ingresaron a 8 unidades de cuidados intensivos neonatales en los Países Bajos, cinco centros en Europa y uno en EE. UU.
Criterios de inclusión :
Prematuros (edad gestacional (GA) ≤ 34 semanas) con hemorragia grado III o IV diagnosticada con Eco cerebral
< 28 días después del nacimiento
Dilatación progresiva de ambos ventrículos laterales con ancho ventricular > p97 y AHW > 6 mm.
Criterios de exclusión :
Alteración cromosómica
Malformaciones congénitas
Leucomalacia periventricular quística
Infección del sistema nervioso central antes de la randomización.
Ecografía cerebral
Se realizó Ecografia cerebral seriada al menos 2 veces por semana despues del diagnóstico de una hemorragia grado III / IV para diagnosticar la PHVD y seguir la evolución. Las mediciones ventriculares, VI / AHW y TOD se realizaron en todas las ecografías y se representaron en los gráficos de Leven y Davies. 12,16
Las mediciones se registraron después del consentimiento informado, al momento de la randomización , antes de cada punción lumbar (LP), 1, 2 y 3 semanas después de la primera LP, antes de la inserción del reservorio ventricular (VR) y semanalmente hasta estabilización, alta o colocación de VP shunt.
Tratamiento
Umbral bajo
El tratamiento se inició después de que el VI cruzó p97 pero antes de cruzar la línea p97 + 4 mm, AHW fue > 6 mm pero < 10 mm y / o DOT > 25 mm (figura 1).

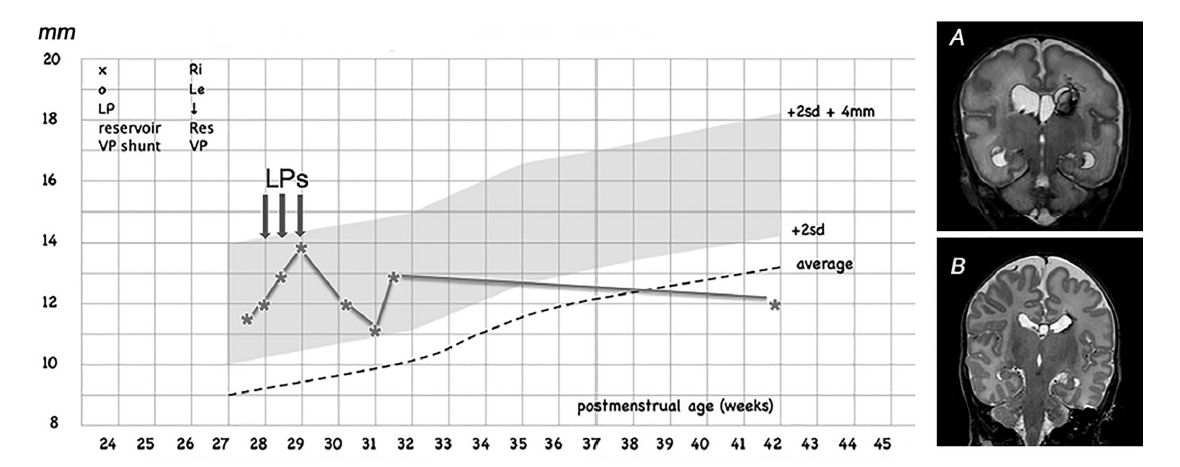
Figura 1.- Ejemplo de intervención temprana, edad gestacional 26 semanas / peso al nacer 925 g; 3 punciones lumbares (LP) se realizaron cuando el índice ventricular o de Levene había cruzado el p97 (2SD) y se dirigía hacia la línea p97 + 4 mm. No se requirió más intervención. La primera MRI (A, secuencia coronal potenciada en T2) se realizó después de las tres PL a las 30 semanas de edad posmenstrual y la segunda MRI (B) a la edad equivalente a término , mostrando hemorragia intraventricular en regresión y tamaño y forma casi normales de los ventrículos laterales . VP, ventriculoperitoneal.
La intervención comenzó con PL (máximo 3) y, si fue necesario, seguido de inserción y punciones de un VR (reservorio ventricular), con el objetivo de VI < p97 en los siguientes 7-10 días. 10 mL / kg fueron removidos 1 o 2 veces al día, con volumen ajustado de acuerdo a la CUS (eco cerebral) . Cuando las punciones del RV aún se necesitaban 28 días después de la inserción para mantener el VI muy por debajo del p97 + 4 mm, se realizaron 1 o 2 "desafíos" de interrupción de las punciones de reservorio. Las punciones para retiro de líquido del reservorio se reanudaron en caso de expansión de los ventrículos, si habían síntomas clínicos y / o crecimiento excesivo de la cabeza. Las punciones se continuaron hasta que el peso del niño alcanzó 2000-2500 gy, de acuerdo con el protocolo de la unidad, la proteína disminuyó a < 1.5 g / L y los eritrocitos < 100 / mm3, momento en el cual el niño llegó a ser elegible para derivación VP.
Umbral alto
El tratamiento se inició una vez que el VI había cruzado la línea p97 + 4 mm y el AHW era > 10 mm. El tratamiento adicional fue comparable al brazo de tratamiento temprano (figura 2).
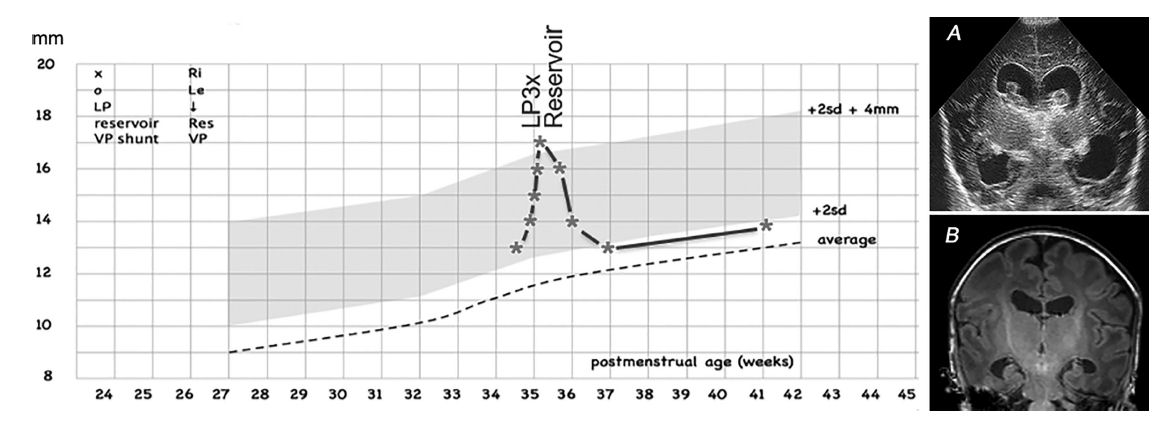
Figura 2 .-
Ejemplo de intervención posterior, edad
gestacional 33 + 6 semanas / peso al nacer 1790 g; se realizaron 3 punciones
lumbares (LP) una vez que el índice ventricular había cruzado la línea p97 + 4 mm y posteriormente se insertó un reservorio ventricular. El índice ventricular
descendió por debajo de la línea p97 con punciones para drenaje diarias desde el reservorio
ventricular, que podrían detenerse después de 19 días. No se requirió más
intervención. La ecografía coronal (A) realizada antes de la primera LP muestra
coágulos intraventriculares y forma abultada de los ventrículos laterales. La RM
coronal (imagen ponderada en T1) a la edad equivalente del término (B) muestra
dilatación ventricular leve. VP , ventriculoperitoneal.
Cirugía de shunt
Cuando se logró peso adecuado, proteína y
eritrocitos adecuados en
líquido cefalorraquídeo (LCR) se interrumpieron las punciones
de drenaje del reservorio y se revisaron diariamente las mediciones de VI / AHW
y de
circunferencia de la cabeza y síntomas clínicos. Si el equipo local observaba
crecimiento ventricular y crecimiento cefálico aumentado ,
se indicó una derivación VP, con síntomas que aumentan la urgencia.
Posteriormente se realizó una revisión externa para los niños que se sometieron
a cirugía de derivación. 2 autores del presente trabajo revisaron los gráficos VI e AHW, los gráficos
de circunferencia de la cabeza y las imágenes CUS para los neonatos con derivación
VP pero
no nacidos en sus propios centros para confirmar que se cumplieron los criterios
de shunt. Eran ciegos a la asignación del tratamiento. Estas revisiones
externas estuvieron de acuerdo con la decisión local de instalar derivación en todos los
casos.
Resultados
El resultado u outcome fue un compuesto de
colocación de derivación VP y / o muerte. Se registró el diagnóstico de
disfunción , infección y revisión de VR o la necesidad de un segundo reservorio,
así como tambien la disfunción de la derivación VP, infección y necesidad de revisión.
El resultado del neurodesarrollo a los 2 años de edad corregida se
informará por separado.
Randomización y analisis estadístico
La randomización generada por computadora se utilizó en línea para asignar bebés a los grupos de tratamiento en una proporción de 1: 1. La randomización se estratificó por centro y en bloques de 5. El análisis fue por intención de tratar. En base a estudios previos, los criterios de inclusión predijeron que el 60% de los neonatos morirían o necesitarían una derivación VP. Nuestro cálculo inicial de potencia (utilizando un nivel de significancia del 5%) indicó que 50 bebés en cada grupo darían un 87% de poder de detección de una reducción del 60% en el outcome primario a 30%. Durante el estudio se encontró que la incidencia de un resultado u outcome adverso era mucho más baja (alrededor del 45%) que el resultado adverso esperado del 60%. Por lo tanto, se realizó un nuevo cálculo de potencia, que indica un tamaño muestral de 63 pacientes por brazo o rama de estudio, para demostrar una disminución en el resultado adverso con un 45% -22% con una potencia del 80%. Se obtuvo el consentimiento informado por escrito de ambos padres de cada bebé.
Resultados
El reclutamiento comenzó en los Países Bajos en julio de 2006 y finalizó en julio de 2016. Debido al bajo enrolamieno se invitó a otros centros a participar, Bristol 2007, San Luis 2009, Lund 2010, Cádiz, Barcelona y Lisboa 2013. Se reclutaron 126 recién nacidos . La mayoría de los bebés fueron reclutados en Bristol (29), Utrecht (23), ijmegen (23), Zwolle (12), Cádiz (12), mientras que entre 2 y 6 niños se inscribieron en los otros 9 centros. Los dos grupos de tratamiento fueron comparables por sexo, edad gestacional y peso al nacer, asi como tambien en tener una hemorragia de grado III o IV y día de randomización (tabla 1).
Tabla 1.- Características clínicas e intervencion y outcomes primarios
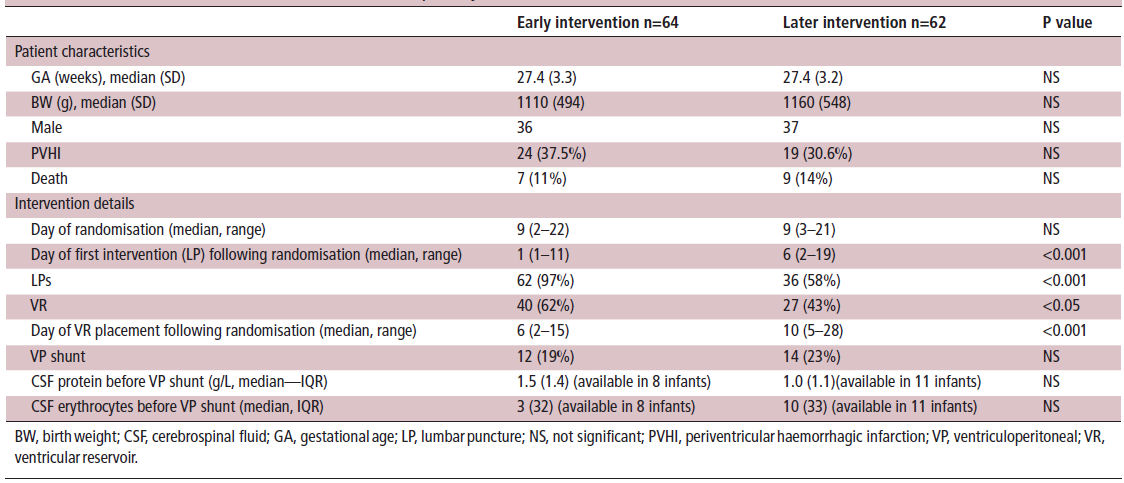
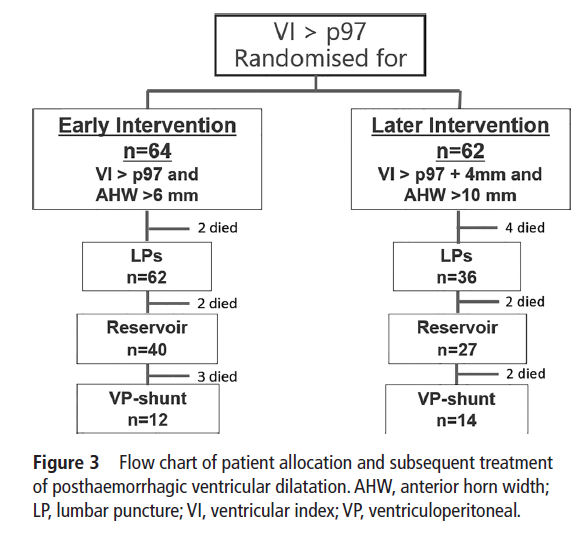
Figura 3.-
Diagrama de flujo de la asignación del
paciente y tratamiento posterior de la dilatación ventricular poshemorrágica.
AHW, ancho del cuerno anterior; LP, punción lumbar; VI, índice ventricular; VP,
ventriculoperitoneal.
Grupo de umbral bajo
Todos menos 2 bebés (97%) tuvieron su primera LP (puncion lumbar) el día de la randomización . 2 bebés no tenían LP, uno era demasiado inestable y el otro debido a una violación del protocolo. La mediana del número de PL fue 3 (rango 0-6), y el número excedió 3 en 12 (19%) niños, debido a la falta de disponibilidad del neurocirujano. Se insertó un RV en 40 recién nacidos (62%), mediana de 6 días después de la primera PL . Disfunción del reservorio ocurrió en 5 niños (8%), debido a dehiscencia en 1, obstrucción en 3 y malposición en 1 , requiriendo un segundo RV en 4 . En el otro bebé, se inyectaron 0.5 mg / kg de plasminógeno tisular recombinante (rTPA) (Actilyse, Boehringer IngelheimInt, Ingelheim, Alemania) en el reservorio, lo que resolvió la disfunción.
Se produjo una infección 2 veces, una con Enterococcus faecalis, que requirió la remoción del RV y en el otro neonato Staphylococcus capitis se cultivó con la esterilización del LCR con antibióticos intraventriculares. Sin embargo, posteriormente se produjo la formación de bolsas multiloculadas, requiriendo fenestración endoscópica 2 veces y derivación VP posterior.
7 recién nacidos murieron (11%), 2 sin ninguna intervención (uno por sepsis por Escherichia coli el día de la randomización y los otros 3 días después de la randomización por insuficiencia respiratoria aguda), 2 después de PL ( 1 sepsis, 1 enterocolitis necrosante (NEC) )) y 3 después de la inserción de RV ( 1 displasia broncopulmonar, 2 NEC).
12 requirieron una derivación VP (19%), incluida una después de fenestración infructuosa del tercer ventrículo dos veces. 7 tenían una hemorragia grado III y 5 tenían una hemorragia grado IV. La revisión del shunt o derivación (< 1 mes después de la inserción) fue necesaria en 7 recién nacidos (58%) debido a una infección en uno (Streptococcus viridans) y disfunción en los otros 6.
Grupo de umbral más alto
36 de 62 (58%) neonatos tenían PL realizadas a una mediana de 5 días después de la randomización. La mediana del número de PL fue 3 (rango 0-4), y el número fue más de 3 en 8 bebés (22%), debido a la falta de disponibilidad del neurocirujano. Se insertó VR en 27 recién nacidos (43%), mediana de 10 días después de la primera PL. La disfunción de VR ocurrió en 6 niños (9%), debido a obstrucción en 3 , malposición en 1 y falta de comunicación entre los 2 ventrículos que requirieron la colocación de un segundo reservorio en 2. Una infección con Staphylococcus aureus y Klebsiella pneumoniae ocurrieron en otros 2 bebés, ambos fueron tratados con antibióticos sin remoción del RV.
9 bebés murieron (14%), 4 sin ninguna intervención (2 sepsis, 1 NEC, 1 insuficiencia respiratoria aguda), 3 siguientes a PLs (1 sepsis, 1 DBP , 1 meningitis después del alta a domicilio ) y 2 después de la inserción de un VR (1 sepsps por candida , 1 NEC).
14 bebés requirieron una derivación VP (23%), 7 después de una Hemorragia grado III y 7 después de una hemorragia grado IV. Un bebé necesitó una revisión después de una infección, 1 tuvo una desconexión pero la derivacion VP no fue revisada y en 1 bebé se realizó una segunda fenestración.
Comparación de outcome primario entre intervención precoz y tardía
Los resultados al alta se muestran en tabla 1 y Figura 3. De 64 recién nacidos asignados al grupo LT, 7 (11%) fallecieron y 12 (19%) se sometieron a cirugía de derivación VP (muerte o derivación 30%).
De los 62 neonatos asignados al grupo HT, 9 murieron (14%) y
14 (23%) requirieron colocación de derivación VP (muerte o VP shunt 37%).
Esta diferencia no fue significativa (P = 0.45). Se requirió la revisión de la
derivación VP en 7/12 (58%) del grupo LT frente a 2/14 (14%) en el grupo HT (P
< 0.01). Esto no podría explicarse por una diferencia en los niveles de proteína
o eritrocitos en el LCR antes de la colocación del shunt o derivación VP.
La randomización se realizó en mediana de 9 días en ambos brazos del estudio,
seguido de un número significativamente mayor de PL en grupo LT (p < 0,001).
La primera intervención después de la randomización se realizó en mediana de 1
día en LT, en comparación con mediana día 6 en grupo HT (p
< 0.001). La inserción posterior de un RV también se realizó con mayor
frecuencia en grupo LT (62% del grupo precoz l, 43% grupo HT, P < 0,05). La
inserción se realizó a una mediana de 6 días después de randomización en
grupo LT, en comparación con día 10 en grupo HT (p < 0,001).
La disfunción de VR se produjo en 5/40 (12.5%) del grupo LT versus 6/27 (22%) en grupo HT. La mediana de las mediciones de VI máximo (mm sobre p97) fueron 2.7 mm en grupo LT, en comparación con 4.0 mm en grupo HT (p < 0. 001). Mediana de mediciones máximas de AHW (mm más de 6 mm) fueron 3.0 mm en LT y 5.0 mm en grupo HT (P < 0.001) (figura 4).
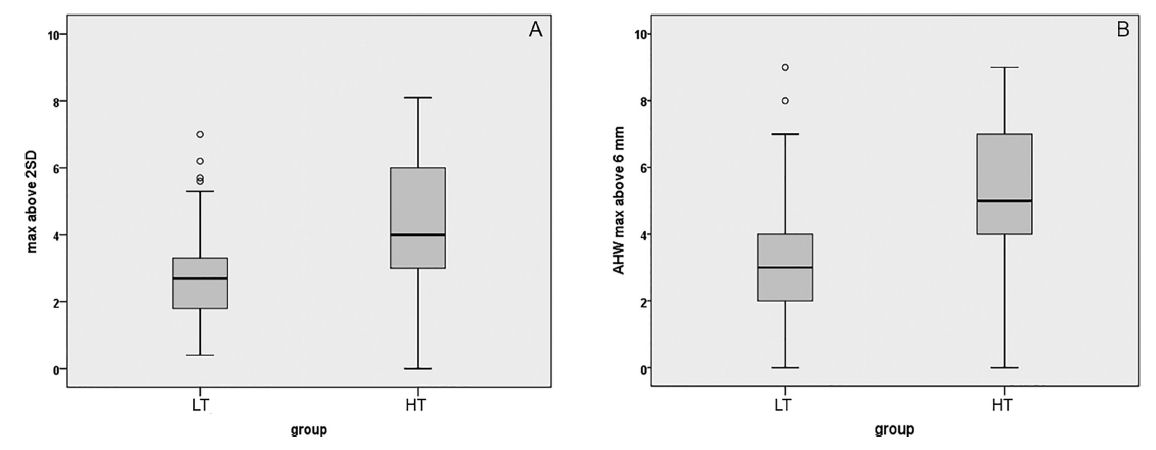
Figura 4.-
Mediana
de mediciones
ventriculares máximas incluido índice ventricular en mm por encima de
la línea +2 SD en eje Y a la izquierda (panel A) y ancho del asta anterior (AHW)
en mm por encima de la línea de 6 mm en eje Y a la derecha (panel B), para los
bebés en grupo umbral bajo (LT) y umbral alto (HT) representado en eje X. La
mediana de las mediciones del índice ventricular máximo (mm > 2SD) fue 2.8 mm
en el grupo precoz en comparación con 4.2 mm en grupo de intervención
más tardía (p < 0.001). La mediana de las medidas máximas del ancho del cuerno
anterior (mm > 6 mm) fue 3.0 mm en el precoz y 5.0 mm en el grupo de
intervención más tardía. (P < 0.001).
Violación del protocolo
En el grupo LT, la primera PL se realizó
demasiado pronto en dos bebés, cuando el VI todavía estaba en p97 pero sin
progresión hacia arriba. En otros 2 recién nacidos, el VI nunca bajó < p97
y varias mediciones fueron más de p97 + 4 mm (ver figura suplementaria
online).
En el grupo HT, la primera PL se realizó antes de que el VI hubiera cruzado la línea p97 + 4 mm en 3 recién nacidos. No se realizó PL > p97 + 4 mm en 2 neonatos ya que eran demasiado inestables y ambos fallecieron posteriormente. La randomización se produjo demasiado temprano, cuando el VI estaba en , pero aún no había cruzado, la línea p97 y sin progresión de PHVD. En 2 recién nacidos, el VI nunca se redujo < p97 y varias mediciones permanecieron > p97 + 4 mm.
Reservorios Ventriculares
Ningún neurocirujano estuvo disponible en sitio en 2 centros holandeses y en 1 de los 2 hospitales en Bristol. Los bebés fueron derivados después de la randomización y cuando se esperaba la necesidad de neurocirugía. La colocación del reservorio se realizó en el quirófano en 10/14 centros. Los drenajes del reservorio fueron realizados por personal neonatal en 12 y por personal de neurocirugía en los otros 2 centros. Hubo más complicaciones relacionadas con el reservorio en los bebés tratados durante la primera mitad que en la segunda mitad del período de estudio (10/19 y 5/33, respectivamente (P = 0.01)). No hubo diferencias significativas en EG o peso al nacer para niños con y sin complicaciones.
Discusión
No pudimos mostrar una reducción adicional
en la necesidad de derivación VP en el grupo LT, pero la necesidad de
colocación de derivación VP en ambos grupos de estudio es, hasta donde sabemos,
la más baja reportada hasta el momento. En el grupo HT, el número de neonatos que
tenían PLs y VRs fue significativamente menor que en grupo LT. Si este aumento
en las intervenciones adicionales en el grupo LT se asociará con una mejor
preservación de los volúmenes cerebrales y un mejor resultado del
neurodesarrollo, aún está por ser determinado. La intervención puede ser considerada
precoz en ambos grupos, cuando se compara con el momento de la intervención en
estudios previos. En el primer estudio controlado randomizado (RCT) realizado,
el estudio VentriculoMegaly, no hubo límite superior en VI al ingreso y solo
se realizaron PL o drenajes ventriculares.
Estos métodos solo se usaron para evitar
una mayor dilatación, pero no para reducir el VI al rango normal.13 No hubo una
diferencia significativa entre el número de niños con derivaciones VP entre los
dos grupos (53% y 54%). El siguiente RCT , que utilizó acetazolamida y
furosemida, tampoco tenía límite superior para VI en el momento de la entrada.
7 % tenía una RV insertada en el brazo que recibía fármacos y
14% en el brazo de estudio estándar.14 El número de niños con
derivación VP fue
significativamente mayor en el grupo de tratamiento (51%) en comparación con el
grupo de tratamiento estándar (38%) y el el resultado compuesto (muerte y / o shunt) fue significativamente peor en el grupo de tratamiento también.
El estudio DRIFT (drenaje, irrigación y terapia fibrinolítica) tampoco tuvo un límite
superior en el VI al ingreso. 38% en el brazo DRIFT tenía
inserción VR y 75% en el grupo estándar.
Una vez más, no hubo una diferencia
significativa entre el número de niños con derivación VP entre los dos grupos
(38% y 39%). Un reciente estudio prospectivo de cohorte de la Red de
Investigación Clínica Hydrocephalus informó que 56% de los pacientes tratados
cuando la relación del cuerno frontal-occipital excedía 0.55 con síntomas
clínicos tenía derivación VP.19 En un estudio de cohorte observacional reciente, hasta
el 92% de los bebés prematuros requirió una derivación cuando el tratamiento se
inició después del inicio de los síntomas clínicos. 20
El enrolamiento en el presente estudio fue mucho más lento de lo esperado, ya que
un menor número de niños desarrollaron un GMH-IVH severa. El cumplimiento con el
manejo del estudio fue en general bueno, pero la interpretación del protocolo
fue inapropiada en aproximadamente el 10% de los casos, pero después de la
intención de tratar, estos recién nacidos se incluyeron en el análisis.
La tasa de infección para los diferentes métodos de intervención fue baja. La infección del sistema nervioso central no se produjo después de las LP y en solo el 6% de los recién nacidos después de la inserción de RV, similar a un estudio previo único.21 Se requirió un segundo RV en aproximadamente el 15% de los niños, principalmente debido a la disfunción. Ambos tipos de complicaciones pueden aumentar aún más el riesgo de un resultado adverso. Se sabe que la infección tiene un efecto adverso sobre el resultado, incluso cuando no hay evidencia de que el SNC esté involucrado22.
Las complicaciones fueron menos comunes durante la segunda mitad del período de estudio, lo que sugiere una curva de aprendizaje. Recientemente, se ha prestado más atención al riesgo de anestesia en niños pequeños y ésto puede ser especialmente importante en recién nacidos extremadamente prematuros.23,24 La proporción de derivaciones de VR y VP con disfunción que necesita revisión fue mayor en el grupo LT que en el grupo HT. Aunque, en la mayoría de los centros, la inserción de una derivación VP solo se realizó cuando el bebé había alcanzado un peso de 2 - 2.5 kg y cuando el recuento de proteína y glóbulos rojos era bajo, la necesidad de revisión era alta (25%), lo cual era debido a desconexión o disfunción en la mayoría de los casos.
Cada necesidad
de revisión involucró un período de aumento de la presión intracraneal y
necesidad de anestesia.
Cada revisión está asociada con una
pequeña reducción en puntos de CI25. En el estudio DRIFT, no hubo una
reducción significativa en la necesidad de una derivación VP, pero se observó
una mejora posterior en el resultado del desarrollo neurológico a los 2 años de
edad corregida en el brazo DRIFT. 26
En el estudio actual, determinaremos si el aumento en el número de intervenciones (neuroquirúrgicas) necesarias en el brazo de estudio temprano influye en el resultado del neurodesarrollo.
Conclusiones
El control de PHVD, usando punciones lumbares y drenajes desde un VR (reservorio ventricular) antes o justo después de que el VI cruzó la línea p97 + 4 mm, se asoció con menor necesidad de derivación VP reportada hasta el momento.
No se encontraron reducciones significativas en la inserción de derivación VP y no se encontraron diferencias en la mortalidad después de una intervención muy temprana en comparación con intervención más tardía para PHVD, pero la intervención a p97 + 4 mm implicó menos PL e inserciones de reservorios.
Referencias
et al. Incidence and evolution of subependymal and intraventricular hemorrhage: a study of infants with birth weights less than 1,500 gm. J Pediatr 1978;92:529–34.
Papile LA, Burstein J, Burstein R,
de Vries LS, Liem KD, van Dijk K,
Brouwer A, Groenendaal F, van Haastert IL,
Ahn SY, Shim SY, Sung IK. Intraventricular hemorrhage and post hemorrhagic hydrocephalus among very-low-birth-weight infants in Korea.
Ingram MC, Huguenard AL, Miller BA,
De Vries LS, Pierrat V, Minami T,
Klebermass-Schrehof K, Rona Z, Waldhor T,
van Alfen-van der Velden AA, Hopman JC, Klaessens JH,
Norooz F, Urlesberger B, Giordano V,
Olischar M, Klebermass K, Hengl B,
Kochan M, McPadden J, Bass WT,
Levene MI. Measurement of the growth of the lateral ventricles in preterm infants with real-time ultrasound. Arch Dis Child 1981;56:900–4.
Randomised trial of early tapping in neonatal posthaemorrhagic ventricular dilatation. Ventriculomegaly trial group. Arch Dis Child 1990;65(1 Spec No):3–10.
International randomised controlled trial of acetazolamide and furosemide in posthaemorrhagic ventricular dilatation in infancy. International PHVD drug trial group. Lancet 1998;352:433–40.
Whitelaw A, Evans D, Carter M, et al. Randomized clinical trial of prevention of hydrocephalus after intraventricular hemorrhage in preterm infants: brain-washing versus tapping fluid. Pediatrics 2007;119:e1071–e1078.
Davies MW, Swaminathan M, Chuang SL, et al. Reference ranges for the linear dimensions of the intracranial ventricles in preterm neonates. Arch Dis Child Fetal Neonatal Ed 2000;82:218F–23.
Brouwer MJ, de Vries LS, Groenendaal F, et al. New reference values for the neonatal cerebral ventricles. Radiology 2012;262:224–33.
Bassan H, Eshel R, Golan I, et al. Timing of external ventricular drainage and neurodevelopmental outcome in preterm infants with posthemorrhagic hydrocephalus. Eur J Paediatr Neurol 2012;16:662–70.
Wellons JC, Shannon CN, Holubkov R, et alShunting outcomes in posthemorrhagic hydrocephalus: results of a hydrocephalus clinical research network prospective cohort studyJ Neurosurg Pediatr 2017;20:19–29.
Leijser LM, Miller SP, van Wezel-Meijler G, et al. Posthemorrhagic ventricular dilatation in preterm infants. Neurology. 2018. In Press.
Brouwer AJ, Groenendaal F, van den Hoogen A, et al. Incidence of infections of ventricular reservoirs in the treatment of post-haemorrhagic ventricular dilatation: a retrospective study (1992-2003). Arch Dis Child Fetal Neonatal Ed 2007;92:F41–F43.
Stoll BJ, Hansen NI, Adams-Chapman I, et al. Neurodevelopmental and growth impairment among extremely low-birth-weight infants with neonatal infection. JAMA 2004;292:2357–65.
Andropoulos DB, Greene MF. Anesthesia and developing brains - implications of the FDA warning. N Engl J Med 2017;376:905–7.
Filan PM, Hunt RW, Anderson PJ, et al. Neurologic outcomes in very preterm infants undergoing surgery. J Pediatr 2012;160:409–14.
Arrington CN, Ware AL, Ahmed Y, et al. Are shunt revisions associated with iq in congenital hydrocephalus? A meta -analysis. Neuropsychol Rev 2016;26:329–39.
Whitelaw A, Jary S, Kmita G, et al. Randomized trial of drainage, irrigation and fibrinolytic therapy for premature infants with posthemorrhagic ventricular dilatation: developmental outcome at 2 years. Pediatrics 2010;125:e852–e858.