Diagnostico de Sepsis neonatal
Enero 2023
Diagnóstico de sepsis neonatal : pasado, presente y futuro
Istemi Han Celik Pediatric Research (2022) 91:337–350
Introducción
La sepsis neonatal es un síndrome clínico
caracterizado por signos y síntomas inespecíficos causados por la invasión de
patógenos.1,2 La sepsis se considera comprobada por cultivo si se confirma por
crecimiento microbiano en hemocultivos u otros fluidos corporales estériles.
Existe debate sobre la ocurrencia de sepsis con cultivo negativo y si se debe
continuar con los antibióticos en los casos con cultivo negativo 3 .
La sepsis neonatal se clasifica como Inicio temprano si se diagnostica dentro de las primeras 72 horas de vida , la cual se debe a factores de riesgo perinatales o de inicio tardío si se diagnostica después de las 72 h y es secundaria a factores de riesgo nosocomiales. La sepsis neonatal sigue siendo una causa importante de morbilidad y mortalidad a pesar de los avances en la medicina neonatal.4
La incidencia varía de 1 a 4
casos por cada 1.000 nacidos vivos en países de ingresos altos, pero tan alta
como
49–170 casos en países de ingresos bajos y medianos. países con una tasa de
letalidad de hasta el 24 %.5–8 Los sobrevivientes de sepsis neonatal tienen un
mayor riesgo de outcomes adversos del neuro desarrollo, incluyendo parálisis
cerebral, pérdida de la audición, discapacidad visual y retrasos cognitivos,
incluso en aquellos cuyos cultivos fueron negativos pero fueron tratados con
antibióticos.9,10
El diagnóstico de sepsis confirmada se basa en técnicas de cultivo
microbiológico convencionales, que pueden llevar mucho tiempo.11 A pesar de la
alta sensibilidad para detectar cargas bacterianas bajas (1–4 unidades
formadoras de colonias (UFC)/mL), muchos clínicos ven con escepticismo los hemocultivos negativos cuando se presentan con un bebé enfermo.12 El diagnóstico
de sepsis con "cultivo negativo" o "sepsis clínica" ha llevado a un aumento de
10 veces en el uso de antibióticos en recién nacidos con evidencia de daño no
intencional, incluyendo mayor riesgo de enterocolitis necrotizante,
infecciones fúngicas, displasia broncopulmonar y muerte.12
Los avances en las técnicas de cultivo
rápido, la administración racional de antibióticos y los enfoques en bundle (agrupados) para prevenir
las infecciones del torrente sanguíneo asociadas a línea central han reducido
la morbilidad y la mortalidad por sepsis neonatal. 13,14 Se necesitan
nuevas aproximaciones moleculares y métodos no basados en cultivo para ayudar en
la detección oportuna y precisión diagnóstica de sepsis. Los biomarcadores actuales y los índices hematológicos complementarios utilizados en
la práctica clínica habitual tienen un valor limitado y son difíciles de
interpretar debido a la baja sensibilidad y a los cambios en los rangos normales
durante el período neonatal.15,16 Un marcador ideal debe tener una sensibilidad
y un valor predictivo negativo (VPN) cercanos a 100 %; especificidad y valor
predictivo positivo (VPP) superior al 85 %.17,18 Ninguno de los biomarcadores o
combinación de biomarcadores tiene una
precisión diagnóstica adecuada para ser utilizado de manera confiable en el diagnóstico
de sepsis neonatal.19 Nuestro objetivo es revisar las modalidades de diagnóstico
pasadas y actuales y presentar algunas ideas sobre las futuras estrategias de
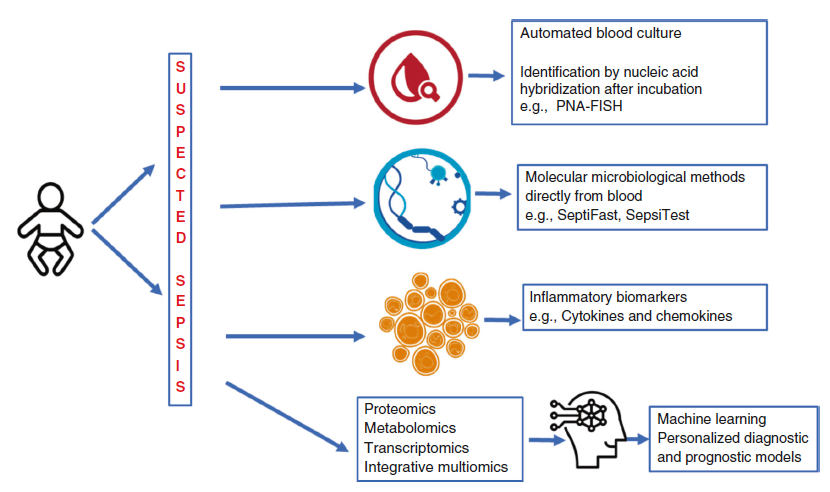
diagnóstico en la sepsis neonatal (Figura 1).

Figura 1.- Esquema de las categorías de pruebas diagnósticas disponibles para la sepsis neonatal. Los métodos tradicionales de hemocultivos han cambiado a la monitoreo automatizado de hemocultivos para crecimiento bacteriano mediante la detección de CO2. Los tests más nuevos implican la identificación rápida de organismos a partir de cultivos positivos mediante técnicas de hibridación fluorescente in situ. El diagnóstico microbiológico molecular mediante PCR para genes bacterianos y fúngicos se puede aplicar directamente a las muestras de sangre. Los biomarcadores inflamatorios que incluyen PCR, procalcitonina y citocinas son otra categoría de pruebas de diagnóstico complementarias. La tecnología multiómica nos permite explorar la expresión génica, las proteínas y los metabolitos de todo el genoma para desarrollar pruebas de diagnóstico y modelos pronósticos.
Fisiopatología de sepsis neonatal
Las respuestas inmunes del huésped, incluyendo citocinas y quimiocinas, reducen la gravedad de la sepsis. En figura 2 se muestra un resumen de los biomarcadores asociados con las vías inmunes del huésped que cambian durante la sepsis. Las células de Paneth y las células linfoides intestinales producen interleucina-17 (IL-17), la cual tiene un rol en la defensa local y en el desarrollo de la respuesta inflamatoria sistémica. 20 El epitelio respiratorio secreta proteínas y péptidos antimicrobianos, incluyendo catelicidina y β-defensinas 21. Los microorganismos gram + y su ácido lipoteicoico de la pared celular emiten señales a través del receptor tipo toll-2 (TLR-2), mientras que los microorganismos gramnegativos y su lipopolisacárido (LPS) secretado emiten señales a través de los receptores TLR-4.22 Estas cascadas de señalización están asociadas con la producción de citocinas y quimiocinas inflamatorias dependientes del factor nuclear κB. Los receptores similares a dominios de unión a nucleótidos y de oligomerización conducen a la producción de IL-1β e IL-18 por un complejo de proteínas llamado inflamasoma.23 La activación de los receptores de reconocimiento de patógenos da como resultado la generación de mediadores inflamatorios como IL-1β, IL-6, IL-8, IL-12, IL-18, interferón-γ (INF-γ) y factor de necrosis tumoral-α (TNF-α).24
Las citocinas proinflamatorias activan las células endoteliales, causando mayor expresión de moléculas de adhesión celular, tales como moléculas de adhesión intercelular solubles, selectinas, angiopoyetinas, CD11b y CD18. 25
Las quimiocinas, incluidas CXCL10, CCL5 (RANTES) y CCL3, y las proteínas del complemento, tales como la catelicidina C3a y C5a y las defensinas, también son estimuladas por las citocinas proinflamatorias.26
Los patterns moleculares asociados a daño (DAMPS, alarminas) tales como grupo de alta movilidad box-1 y ácido úrico, son liberados de las células dañadas e inducen la producción de citoquinas, la cascada de coagulación y regulan la función de las células polimorfonucleares. 27
Citoquinas antiinflamatorias tales como factor de crecimiento transformador - β, IL-4, IL-10, IL-11 e IL-13 se expresan para controlar y equilibrar la inflamación.28
Los reactantes de fase aguda (APRs), tales como proteína C reactiva (PCR), procalcitonina (PCT), amiloide sérico A (SAA) son producidos predominantemente en el hígado en respuesta a la activación del complemento. actividad de patrones moleculares asociados a patógenos (PAMPs) y secreción de citoquinas proinflamatorias.

Figura 2.-
La relación entre la inmunidad del huésped y los biomarcadores. CD : Clúster de
diferenciación, sTREM-1 : receptor desencadenante soluble expresado en células mieloides-1,
ICAM : molécula de adhesión intracelular , VCAM : molécula de adhesión de
células vasculares, RNA : ácido ribonucleico , DNA : ácido desoxirribonucleico ,
DAMPs : patrones moleculares asociados al daño, HGM-1 : alta movilidad
caja de grupo 1, LPS : lipopolisacárido , LTA : ácido lipoteicoico ,
NETs : trampas
extracelulares de neutrófilos , TLR : receptor tipo toll , HSP : proteína de choque
térmico, TNF-alfa : factor de necrosis tumoral alfa , INF-γ : interferón-γ
, IL : interleucina , MCP-1 : proteína quimioatrayente de monocitos-1,
CXCL-10 : ligando-10 de quimiocina .
Métodos actuales para diagnóstico de sepsis neonatal
Métodos de cultivo microbiológicos
Las técnicas de cultivo convencionales
siguen siendo el “estándar de oro” para confirmar el diagnóstico de sepsis
neonatal. La introducción de sistemas automatizados que detectan la presencia de
crecimiento a partir de la producción bacteriana de CO2 ha reducido el tiempo de
detección del organismo a 24-48 horas.29,30 Los factores que pueden influir en la
recuperación de patógenos de la sangre incluyen la cantidad de volumen sanguíneo
obtenido, el momento de recolección y número de muestras recolectadas. En los
recién nacidos, la presencia de bacteriemia baja o intermitente y la exposición
a antimicrobianos intraparto materna pueden disminuir la sensibilidad de los
hemocultivos.12,31 El retraso en la identificación de patógenos y los
tests de
susceptibilidad a los antibióticos aumenta la exposición a los antibióticos de
amplio espectro, lo que puede conducir a resistencia bacteriana a los
antibióticos y retraso en la terapia antimicrobiana dirigida (targeting) .9,32,33
El volumen de sangre muestreado para cultivos es el factor individual más importante que influye en la recuperación de patógenos de los hemocultivos.34 Sin embargo, la recolección del volumen de sangre óptimo puede ser difícil en bebés extremadamente prematuros y la flebotomía repetida puede aumentar el riesgo de requerir transfusiones de sangre. Schelonka et al. reportaron que un volumen de hemocultivo de 1 ml inyectado en frascos de hemocultivo pediátrico tuvo una excelente sensibilidad incluso si los organismos estaban presentes en concentraciones muy bajas (< 4 unidades formadoras de colonias (UFC)/ml).31
No está clara la necesidad de obtener cultivos para anaerobios en los recién nacidos antes de comenzar con los antibióticos.35 La incidencia general de aislamientos de anaerobios clínicamente significativos encontrados en una población neonatal fue 0.2 % de todos los hemocultivos realizados.36 Estudios previos mostraron que el uso de hemocultivos para anaerobios condujo a mayor identificación de bacterias aerobias y anaerobias facultativas.37 Créixems et al. reportaron que entre 10.024 hemocultivos pareados (aerobios y anaerobios), 19 % de los pacientes con bacteriemia se habrían pasado por alto si se hubieran utilizado cultivos aeróbicos solos, no incluyendo las tres infecciones estrictamente anaerobias identificadas.38 Por el contrario, Dunne et al. encontraron mayor sensibilidad en el aislamiento de aerobios y anaerobios facultativos aislados de pacientes pediátricos cuando se realizaron dos hemocultivos aerobios versus cultivos pareados aerobios/anaerobios.39 No está claro si el tratamiento de anaerobios en el manejo rutinario de la sepsis neonatal mejora los outcomes clínicos.
Métodos de prueba rápidos a partir de hemocultivos positivos
Se han desarrollado varios sistemas de diagnóstico para la identificación rápida de organismos encontrados en hemocultivos positivos y proporcionan tiempos de respuesta más rápidos en comparación con los métodos convencionales (Tabla 1).40 Estos sistemas autorizados por Administración de Food and Drug identifican rápidamente los organismos que crecen en hemocultivos positivos, pero no eliminan el tiempo requerido para el crecimiento de estos cultivos. Las tinciones moleculares de hibridación in situ fluorescentes de ácidos nucleicos peptídicos41 son un método bien validado; el nuevo sistema QuickFISH ha reducido el tiempo de respuesta a 20 minutos, lo que permite que los resultados de identificación de especies se notifiquen en el mismo período de tiempo que la tinción de Gram.42 Los métodos basados en la reacción en cadena de la polimerasa (PCR), incluyendo GeneXpert (1 h), FilmArray (1 h ), y Verigene (2,5 h), son algo más lentos que QuickFISH, pero tienen poco o ningún procesamiento de muestras e incluyen genes de resistencia a antibióticos seleccionados. 40 Los estudios rápidos representan cada vez menos trabajo intensivo y han llevado a mejores outcomes clínicos, estadías hospitalarias más cortas y costos de atención médica drásticamente más bajos.43,44

Los avances recientes en las técnicas
moleculares permiten la amplificación de patógenos microbianos directamente a
partir de muestras de sangre total en menos de 12 h sin depender del crecimiento
microbiano inicial en hemocultivos (Tabla 1).40 Esto
proporciona la ventaja de la identificación en el mismo día y la identificación
temprana de terapia antimicrobiana específica apuntada a patógenos ,
especialmente en entornos donde hay pretratamiento con antibióticos, bacteriemia
de baja densidad o donde la sepsis con cultivo negativo es común. Estas técnicas
moleculares se basan predominantemente en los métodos de amplificación de PCR
para los genes de ARN ribosómico (ARNr) 16S o 23S bacteriano y el gen de ARNr
18S de hongos.
Se ha reportado la precisión diagnóstica de sistemas tales como SeptiFast, SepsiTest y, más
recientemente, la detección de ADN del patógeno amplificado por PCR de la sangre que
se hibrida para capturar nanopartículas decoradas con sonda detectables por una
pequeña plataforma portátil de resonancia magnética (RM) T2. 45–48 El sistema
Roche Light Cycler SeptiFast requiere 100 μL de sangre y puede detectar 25
patógenos conocidos por causar >90% de las infecciones del torrente sanguíneo,
con un tiempo de respuesta de 6 h.
Un ensayo comercial competitivo, SepsiTest, es capaz de detectar > 300 patógenos; sin embargo, con un tiempo de respuesta relativamente más lento de 8 a 12 h.46 El T2 MR es un estudio de PCR automatizado basado en nanopartículas que puede detectar tan solo 1 UFC/mL de Candida spp en sangre en ~ 3 h.46 Algunos estudios reportan una discordancia entre el cultivo convencional y los métodos de PCR durante la validación de los métodos de detección molecular de patógenos, lo que ha llevado a una incertidumbre continua sobre la etiología bacteriana de la sepsis.49,50
Además, los resultados falsos positivos se observaron con umbrales de ciclo altos, lo que abrió la posibilidad de una amplificación inespecífica y planteó dudas sobre si la bacteria presente era la causa del síndrome de sepsis.51 Una revisión sistemática concluyó que el diagnóstico molecular tenía valor como pruebas complementarias con una sensibilidad general de 90 % y especificidad del 96%.52 Los estudios moleculares no están fácilmente disponibles, pueden ser costosos y tienen una precisión diagnóstica modesta. Por lo tanto, los estudios moleculares no están listos para reemplazar los hemocultivos como estándares de referencia, pero son útiles como pruebas complementarias en el diagnóstico de sepsis neonatal.
Indices Hematológicos
Los recuentos de leucocitos (< 5.000 o
≥ 20.000/mm3), neutrófilos absolutos (<1000 o ≥5000/mm3) y neutrófilos
inmaduros/totales (>0,2) y frotis de sangre periférica (granulación tóxica,
vacuolización y cuerpos de Dohle) se utilizan tradicionalmente para ayudar al
diagnóstico de sepsis neonatal (Tabla 2).53
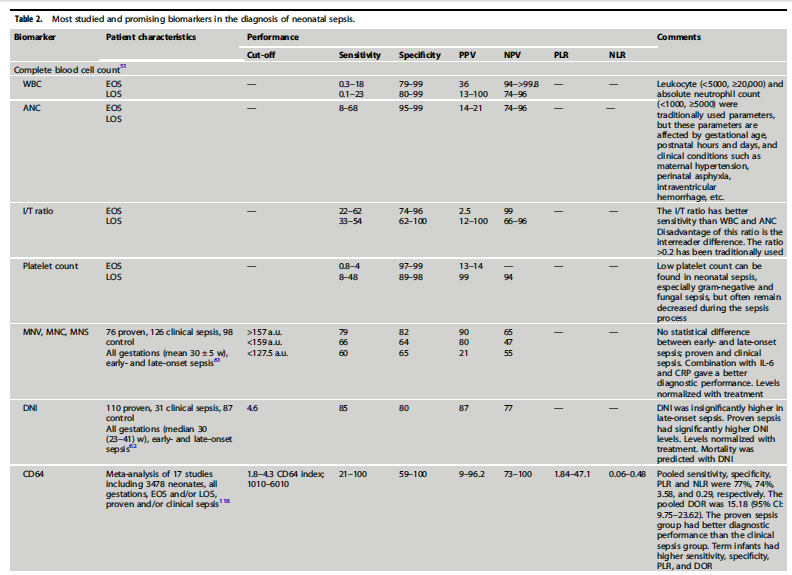

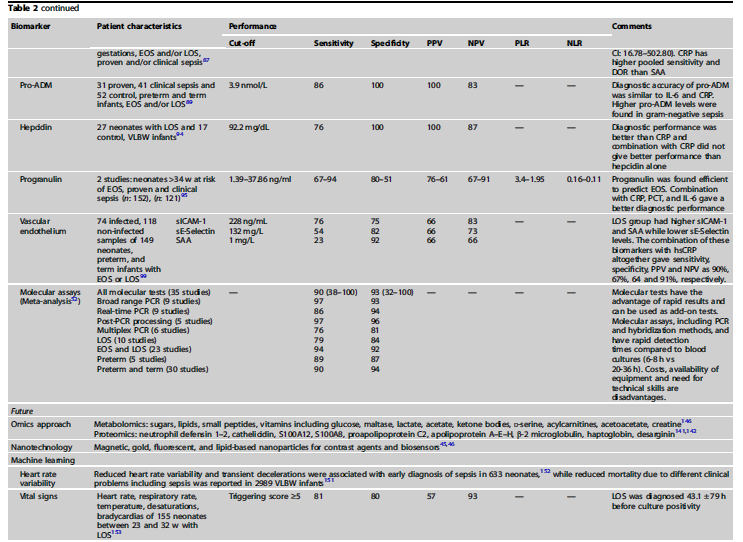

Recuento de glóbulos blancos (WBC).
El recuento de leucocitos comienza entre 6.000 y 30.000/mm3 en el primer día de vida y disminuye a 5.000 - 20.000 mm3 más tarde. El recuento de neutrófilos tiende a ser más bajo a edades gestacionales más bajas (EG) y alcanza un peak de 6 a 8 h después del nacimiento.54 Condiciones clínicas tales como fiebre e hipertensión materna, asfixia perinatal, síndrome de aspiración de meconio, vía de parto, hemorragia intraventricular, hemólisis, neumotórax, convulsión , e incluso el llanto afectan el recuento de neutrófilos.55 Una revisión de la literatura realizada por Sharma et al. reportó que leucopenia (recuento de glóbulos blancos < 5.000 / mm3) tiene baja sensibilidad (29 %), pero alta especificidad (91 %) para diagnóstico de sepsis neonatal.56 Estudios adicionales destacaron que leucopenia es más predictiva de sepsis que leucocitosis (glóbulos blancos > 20.000/mm3) en > 4 h.57 Los cocientes de neutrófilos / linfocitos (NLR) de 1.24 : 6.76 y cocientes de plaquetas / linfocitos de 57.7 : 94.05 pueden ser diagnósticos de sepsis neonatal.58,59
Recuento absoluto de neutrófilos (RAN ).
Los recuentos de neutrófilos se evalúan comúnmente en recién nacidos con sepsis presunta, pero pueden verse afectados por factores de riesgo maternos y neonatales . 54,55 Neutropenia (ANC < 1.000/mm3 at ≥ 4 h) es considerada más específica para sepsis de inicio precoz (EOS) a diferencia de neutrofilia (RAN ≥ 10. 000/ mm3).51,56,60 Sin embargo, la interpretación del RAN debe tener en cuenta la edad gestacional y posnatal del recién nacido, ya que el límite inferior del RAN disminuye con una EG más baja. Además, un análisis de 30.354 hemogramas completos obtenidos en las primeras 72 h de vida demostró que el RAN alcanza su punto máximo más tarde en los recién nacidos prematuros tempranos < 28 semanas de gestación en comparación con los recién nacidos ≥ 28 semanas de gestación (24 h de vida versus 6–8 h, respectivamente).54 El volumen promedio de neutrófilos > 157 unidades arbitrarias tuvo una sensibilidad y una especificidad del 79 % y del 82 %, mientras que la sensibilidad y la especificidad de la Proteína C Reactiva (PCR) fueron 72 % y 99 %, respectivamente.61 En 141 recién nacidos con sepsis neonatal, el nivel de corte del índice de neutrófilos delta se calculó como 4.6 % con una sensibilidad del 85 % y 80 % especificidad , mientras que la PCR tuvo una sensibilidad del 81 % y especificidad del 82 %.62
Relación neutrófilos Inmaduros a
Totales (I :T)
En comparación con otros marcadores
hematológicos, la relación I:T puede ser el indicador más sensible de sepsis
neonatal,60 pero este parámetro también varía con la EG y la edad posnatal. En
recién nacidos sanos, la relación I:T alcanza un máximo de 0.16 durante las
primeras 24 h y disminuye gradualmente a lo largo de los días. Gandhi y Kondekar
proponen que la relación I:T > 0.27 en recién nacidos a término y > 0.22 en
prematuros favorece el diagnóstico de sepsis neonatal60. Murphy y Weiner
demostraron que dos relaciones I:T normales correlacionadas con un hemocultivo
estéril tenían un VPN máximo de 100 %.63
Ancho de distribución de glóbulos
rojos (RDW).
RDW muestra una mayor producción de glóbulos rojos en enfermedades inflamatorias
e infecciosas. Se ha demostrado que una RDW elevada está asociada con una mayor
mortalidad por sepsis tanto en adultos como en recién nacidos.64,65 En
recién nacidos, RDW fue significativamente mayor en sepsis y entre los no
sobrevivientes.66 Los niveles de corte de 16,3 y 19,5 tenían sensibilidad (70
–87%) y especificidad (66,1–81%) en sepsis neonatal y sepsis neonatal de inicio tardío
(LOS) por gramnegativos, respectivamente.64,67
Trombocitopenia.
La trombocitopenia se asocia a sepsis neonatal68. El volumen plaquetario aumenta siendo más activo y asociado a citocinas y mediadores inflamatorios. Un metaanálisis que incluyó 11 estudios y 932 pacientes informó que el VPM (volumen plaquetario promedio) fue mayor en la sepsis neonatal con un nivel de corte entre 8,6 y 11.4.69–71
Biomarcadores inflamatorios
Reactantes de fase aguda (APRs)
Los APRs son producidos por el hígado en respuesta a las citocinas, que son inducidas por infección y lesión tisular. TNF-α, PCR, PCT, fibronectina, haptoglobina, proadrenomedulina (pro-ADM) y SAA se han evaluado en la sepsis neonatal.
Proteína C-reactiva (PCR)
La PCR ha sido el biomarcador más estudiado.16 Las concentraciones séricas de PCR aumentan dentro de las 10 a 12 horas en respuesta a infecciones bacterianas y alcanzan su punto máximo después de 36 a 48 horas, con concentraciones que se correlacionan con la gravedad de la enfermedad.72 Debido al retraso en la elevación, no es confiable para el diagnóstico temprano de sepsis neonatal (baja sensibilidad).15 Además, otras condiciones maternas y neonatales no infecciosas también pueden resultar en niveles elevados de PCR, lo que lo convierte en un biomarcador no específico.72,73 Una revisión sistemática de biomarcadores para sepsis neonatal concluyó que las mediciones seriadas de PCR a las 24-48 horas después del inicio del inicio de los síntomas se ha demostrado aumentan su sensibilidad y VPN y pueden ser útiles para monitorear la respuesta al tratamiento en recién nacidos infectados que reciben antibióticos.16 Esto sugiere que la PCR puede ser más útil para descartar infección y suspender los antibióticos cuando se obtienen mediciones seriadas.
Procalcitonina (PCT)
La PCT se sintetiza en monocitos y hepatocitos como una prohormona de la calcitonina en respuesta a la estimulación con citoquinas. Después del nacimiento, aumenta hasta el día 2–4 después del nacimiento.74 La PCT está regulada a la baja por IFN-γ, una citocina que se produce comúnmente en las infecciones virales.72,75,76 Por lo tanto, la PCT se ha convertido en un biomarcador prometedor para el diagnóstico de infecciones bacterianas que puede ser útil para discriminar entre etiologías bacterianas y virales. Después de la exposición a la endotoxina bacteriana, los niveles de PCT aumentan rápidamente en 2 a 4 horas y alcanzan su punto máximo en 6 a 8 horas, lo que lo convierte en un marcador más sensible que la PCR para el diagnóstico temprano de sepsis neonatal.77 Este aumento a menudo se correlaciona con la gravedad y mortalidad de la enfermedad . Sin embargo, en EOS (sepsis inicio precoz) , las mediciones de PCT al nacer pueden ser inicialmente normales; una medición seriada de PCT a las 24 h de edad puede ser más útil para el diagnóstico temprano.78 Además, las determinaciones seriadas de PCT permiten acortar la duración de la terapia con antibióticos en recién nacidos a término y casi a término con sospecha de sepsis de inicio temprano.79 Sin embargo, antes de que esta estrategia guiada por PCT pueda ser recomendada , su seguridad y confiabilidad deben confirmarse en una cohorte más grande de recién nacidos.
En un metanálisis con 1.959 pacientes, se informó que sensibilidad y especificidad de PCT eran 81 % (intervalo de confianza [IC] del 95 %: 74–87) y 79 % (IC del 95 %: 69–87), respectivamente.80 Estudios en el metanálisis utilizaron diferentes umbrales de corte (0.8-2.4 μg/L). PLR y NLR fueron 7.7 y 0.11 para LOS, mientras que 3.2 y 0.3 para EOS lo que indica que la precisión diagnóstica es mejor en LOS.81 La PCT en sangre de cordón umbilical > 0.7 μg/L en el diagnóstico de sepsis mostró una sensibilidad del 69 % y una especificidad del 70 % y la PCT se ha utilizado en combinación con otros biomarcadores en EOS.82 Canpolat et al. reportaron que PCT (> 1.74 ng/mL) y PCR (> 0.72 mg/dL) tuvieron 76% y 58% de sensibilidad y 58% y 85% de especificidad, respectivamente, al tercer día de vida en neonatos pretérmino con ruptura prematura de membranas .83 Eschborn y Weitkamp evaluaron 29 estudios que compararon PCT con PCR y encontraron que la sensibilidad media para EOS, LOS y EOS + LOS fue 73.6 %, 88.9 % y 76.5 % para PCT; 65.6 %, 77.4 % y 66.4 % para PCR , mientras que la especificidad media para EOS, LOS y EOS + LOS fue 82,8 %, 75,6 % y 80,4 % para PCT; 82,7 %, 81,7 % y 91,3 % para PCR, respectivamente72. Los autores concluyeron que el desempeño de ambos biomarcadores será mejor con mediciones seriadas y que se necesita correlación con los hallazgos clínicos para la toma de decisiones.
Amiloide sérico A (SAA)
SAA es otro APR (Reactante de fase
aguda ) sintetizado por hepatocitos, monocitos, células endoteliales y de músculo liso en 8 a 24 h
después de la exposición bacteriana y está regulado por citocinas
proinflamatorias. Los niveles de SAA aumentan con la edad, con los niveles más
bajos observados en la sangre del cordón umbilical y los niveles más altos
observados en la vejez.84 En respuesta a una infección o lesión, los niveles de
SAA aumentan rápidamente hasta 1.000 veces más que el valor inicial, pero pueden
verse influenciados significativamente por la función hepática y el estado
nutricional del paciente85. En un estudio de Arnon y Litmanovitz, en comparación
con neonatos sanos a las 0, 8 y 24 h, los niveles de SAA en neonatos sépticos
fueron significativamente más altos (p < 0,01) en todos los momentos de
tiempo.
53 En comparación con PCR, SAA tuvo una mejor precisión diagnóstica general para
predecir EOS. Cetinkaya et al. también determinaron que las concentraciones de
SAA tenían mejor sensibilidad y área bajo la curva en comparación con PCR y PCT,
aunque la diferencia no fue estadísticamente significativa.86 Se informaron
diferentes puntos de corte entre 1 y 68 mg/L con una sensibilidad combinada del
78% y 92% de especificidad.87
Proadrenomedulina
La proadrenomedulina es un precursor estable de ADM, que modula la circulación, tiene propiedades antimicrobianas y protege contra el daño de órganos.88 Alta sensibilidad (86,8%), especificidad (100%), VPP (100%) y VPN (83,9%) con un valor de corte de 3.9 nmol/L de pro-ADM se observaron en 76 recién nacidos con sepsis neonatal.89 Los niveles más altos de pro-ADM se asociaron con mayor gravedad y mortalidad de sepsis.90
Adipocinas
Las adipocinas se liberan del tejido adiposo y pueden iniciar la secreción de citocinas inflamatorias y antiinflamatorias. Visfatina (> 10 ng/ml) y resistina (> 8 ng/ml) tuvieron una sensibilidad y especificidad superiores al 90 % en 62 neonatos sépticos.91 Estudios posteriores informaron una menor sensibilidad y especificidad para resistina, pero los niveles se correlacionaron positivamente con IL-6 y PCR.92,93
Otros reactantes de fase aguda
La hepcidina, la progranulina, el factor 1 derivado de células estromales, el endocan y la pentraxina-3 son APRs menos estudiados, que tienen un papel en la inflamación, quimioatracción, activación del complemento, angiogénesis y se necesitan estudios futuros para evaluar la exactitud diagnóstica de estos marcadores.94–98
Endotelio vascular
El endotelio vascular interactúa con leucocitos, mediadores solubles, PAMP y DAMP, que tienen un papel en la patogenia de la sepsis. La selectina E, la selectina L, la molécula de adhesión intracelular soluble-1, la molécula de adhesión de células vasculares soluble-1 y la angiopoyetina 1-2 se estudiaron en el diagnóstico de sepsis neonatal.99 Sin embargo, la limitación de estos estudios de marcadores es que no incluye datos normativos en neonatos, aumento fisiológico en el primer mes de vida y falta de estudios amplios.
Interleukina
La IL-6 aumenta inmediatamente después de la exposición a los patógenos y se normaliza en 24 h.100 La IL-6 tiene un efecto proinflamatorio que induce la liberación de CRP, fibronectina y SAA del hígado, la diferenciación de las células T y la maduración de las células B.101 La IL-6 se ha estudiaron más que otras citocinas y se encontró que aumentaban en recién nacidos con EOS y LOS, y se informaron varios niveles de corte entre 18 y 300 pg/mL en 31 estudios con 1.448 recién nacidos sépticos.102 La sensibilidad y especificidad combinadas de IL-6 fueron 88% y 82%, mientras que PLR y NLR fueron 7.03 y 0.2, respectivamente. La combinación de IL-6 con otros marcadores tales como PCR, pro-ADM y PCT mostró una mejor precisión diagnóstica19,89,103. Cortes et al. evaluaron la precisión diagnóstica de IL-6 y PCR en EOS y LOS.104 Los autores concluyeron que IL-6 (> 17.75 pg/ml) mostró mayor precisión en EOS, mientras que PCR (> 0.53 mg/dL) fue más precisa en LOS . Kurul et al. mostraron que IL-6 (> 580 pg/mL) y PCT (> 0.94 ng/mL) estaban asociadas con mortalidad a los 7 días, mientras que la PCR no lo estaba105.
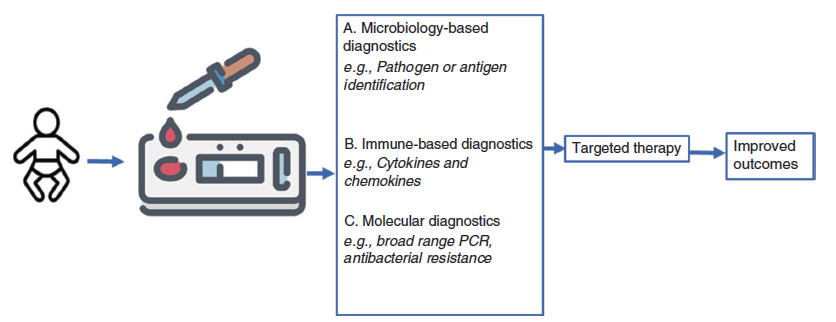
Figura 3.-
Pruebas en el punto de cuidado para el
diagnóstico de sepsis neonatal. Las muestras de sangre se extraen ante la
sospecha de infección en chips de laboratorio que son microbiológicos,
inmunológicos o de diagnóstico molecular. Los resultados nos permiten iniciar
una terapia dirigida. Los resultados rápidos y la terapia dirigida mejorarán los
outcomes clínicos.
Ye et al. evaluaron la utilidad de las
citocinas en 420 recién nacidos con sepsis neonatal.106 Se midieron y compararon
con la PCR la interleucina-2, IL-4, IL-6, IL-10, TNF-α e INF-γ. La interleucina-6
( > 12.5 pg/ml) y la relación IL-6 / IL-10 ( > 3.5) resultaron tan valiosas como la
PCR , mientras que las IL más sensibles y específicas fueron IL-6 (94,1 %) y
relación
IL-6 / IL - 10 (100%), respectivamente. Celik et al. observó que un nivel
de corte de 202 pg/ml para IL-6 diferenciaba la sepsis entre gramnegativos (n =
73) y grampositivos (n = 82) con sensibilidad 68 % y especificidad
58 %.107 En un estudio posterior, IL-6 (> 400 pg/mL) sola o en combinación
con TNF-α (> 32 pg/mL), IL-8 (> 200 pg/mL) y factor estimulante de colonias de
granulocitos (> 1.000 pg/mL) tuvo 100 % de sensibilidad, especificidad, VPN y
38–69 % de VPP para diferenciar la sepsis neonatal por gramnegativos
La IL-8 es otra citocina proinflamatoria que promueve la quimiotaxis y la activación de los granulocitos y aumenta en 1 a 3 h con una vida media < 4 h. La precisión diagnóstica se evaluó en un metaanálisis con ocho estudios con 548 recién nacidos (niveles de corte entre 0,65 y 300 pg/mL), el cual reportó sensibilidad y especificidad agrupadas de 78 y 84 % similar a la PCR.109
El TNF-α es secretado desde células natural killer por IL-2 para inducir proliferación de células T, vasodilatación y adhesión de neutrófilos.110 En una frevisión sistemática (donde los valores de corte de TNF-α variaron desde 1.7 a 70 pg/mL) a un valor de corte promedio de 18.94 pg/m/L, la sensibilidad fue 79 % y la especificidad 81 % y mejor precisión en LOS que en EOS.111 Los metanálisis de datos de recién nacidos muestran sensibilidad y especificidad variables para IL-6, IL-8 y TNF- α con solo precisión moderada en el diagnóstico de sepsis neonatal.16,109,111 Sin embargo, cuando se combinan con otras citocinas o marcadores proinflamatorios tardíos, como PCR, aumentan la sensibilidad y la especificidad.106,112,113
Actualmente, la medición de citocinas para el diagnóstico de sepsis neonatal puede no ser práctica ni costo - efectiva debido a que los inmunoensayos enzimáticos son costosos y consumen mucho tiempo.
Moléculas de adhesión celular:
Los antígenos leucocitarios aumentan después de la exposición bacteriana y pueden cuantificarse mediante citometría de flujo. 114,115 Estos marcadores aumentan en minutos después de la infección y los niveles no se vieron afectados por la GA, el momento del inicio de la sepsis, el tipo de microorganismo o enfermedades no infecciosas.116,117 La limitación de estos marcadores está en la necesidad de alta tecnología y rangos normales no estandarizados.
La molécula de diferenciación de grupos 64
(CD64) expresada en neutrófilos y monocitos facilita la fagocitosis y
la muerte intracelular de microorganismos opsonizados. Se pueden detectar niveles elevados en 1 h y se mantienen estables durante 24 h. Shi et al. realizó
un metaanálisis de niveles de CD64 de 17 estudios, incluyendo 3.478 recién
nacidos, y encontró que la sensibilidad, la especificidad, PLR y NLR
agrupados fueron 77 %, 74 %, 3.58 y 0.29, respectivamente.118 Se han
realizado mediciones en serie y combinación con otros marcadores reportadas con
precisión diagnóstica variable.119,120 Se encontró una mayor expresión de CD11b
tanto en EOS como en LOS con alta sensibilidad y especificidad de hasta el
100%.112 En un metanálisis reciente que incluyó nueve estudios con 843 recién
nacidos, se mostró que CD11b es un biomarcador prometedor con sensibilidad, especificidad, PLR
y NLR de 82%, 93%, 11.51 y 0.19, respectivamente.121
El fragmento soluble de CD14 (presepsina)
es un complejo receptor específico y de alta afinidad de LPSs y activa TLR para
la secreción de citoquinas proinflamatorias. Ambos metanálisis revelaron que la
presepsina era tan precisa como la PCT y la PCR en el diagnóstico de sepsis
neonatal.77,122 Las infecciones por gramnegativos causan niveles más altos
de sCD14.123 Se evaluaron los niveles de presepsina en la sangre del cordón
umbilical en 288 bebés prematuros con ruptura prematura de membranas por EOS
(sepsis de iinicio precoz) y
un nivel de corte ≥1370 pg/mL produjo un cociente de probabilidades (odds
ratio) de 12.6
(nivel de confianza del 95 %: 2,5–28,1).124 Se compararon presepsina, PCT, IL-6
e IL-8 en el diagnóstico de EOS y se encontró que la presepsina era el
biomarcador más preciso con una sensibilidad 88,9 % y especificidad
85,7 %.125
El receptor desencadenante soluble expresado en células mieloides-1 (sTREM-1) regula el sistema inmune innato y la inflamación al promover la liberación de citoquinas proinflamatorias. Se encontraron niveles elevados en sepsis neonatal con un valor de corte de 310 pg/mL, aunque se informaron niveles más altos en sepsis comprobada por cultivo. 126 Urine sTREM-1 >78.5 pg/mL tuvo 90% sensitividad, 78% especificidad , 68% VPP y 94% VPN en 62 neonatos con sepsis, respectivamente.127 Un metanálisis que incluyó ocho estudios con 667 recién nacidos reportó que la sensibilidad y la especificidad de sTREM-1 fueron 95 % y 87 %, respectivamente.128 Las limitaciones incluyen un pequeño número de estudios y diferentes niveles de corte entre 77.5 y 1707 pg/mL.128
El desafío de la identificación de biomarcadores se refleja en el hecho de que se han publicado más de 3.000 estudios de biomarcadores de sepsis con casi 200 biomarcadores candidatos evaluados.129 Sin embargo, no hay un único biomarcador que tenga suficiente precisión diagnóstica para el diagnóstico de sepsis neonatal.
La combinación de biomarcadores o sus mediciones en serie pueden ser estrategias para mejorar la precisión diagnóstica. Se ha sugerido una combinación de IL-6, sTREM-1 y PCT, ya que cada biomarcador representa un componente diferente en la fisiopatología de la sepsis.130 Otros proponen que marcadores de fase temprana y media, como el CD64 de neutrófilos y PCT, deben combinarse con el biomarcador PCR de fase tardía para un beneficio diagnóstico máximo.40 Una revisión reciente de la literatura resume la utilidad de combinar biomarcadores tempranos y tardíos para la sepsis neonatal.130
Estrategias para el futuro
Espectrometría de masas para la
identificación de patógenos a partir de muestras de hemocultivos.
La
espectroscopia de masas con desorción-ionización/tiempo de apagado con láser
asistida por matriz (MALDI-TOF) es un enfoque relativamente nuevo que puede
identificar microorganismos dentro de los 30 minutos posteriores a la
positividad del hemocultivo.131 Los metaanálisis han encontrado que el uso de
MALDI-TOF para el diagnóstico de la infección desde los frascos de cultivo tiene
una sensibilidad y especificidad aceptables132 y con mayor sensibilidad en las
infecciones por gramnegativos en comparación con las infecciones por
grampositivos.133
Dispositivos en punto de cuidado (POC) para el diagnóstico de sepsis neonatal.
Las pruebas rápidas realizadas al lado de la cama que podrían confirmar el diagnóstico o proporcionar información pronóstica tienen el potencial de mejorar los outcomes del paciente y disminuir los costos de atención médica (Figura 3). Se ha demostrado que técnicas novedosas, tales como el análisis de compuestos orgánicos volátiles en el aliento, son razonablemente sensibles y específicas134 y capaces de distinguir la sepsis de la inflamación en modelos de ratas,135 aún por validar en estudios humanos. Los dispositivos POC que utilizan una variedad de biomarcadores, incluyendo la cuantificación de proteínas en plasma sanguíneo y monitoreo de leucocitos, están siendo evaluados para el diagnóstico de sepsis.136
Tecnologías ómicas y medicina personalizada.
Las tecnologías ómicas proporcionan datos sobre la expresión génica de todo el genoma, la traducción de proteínas y la producción de metabolitos que se regulan de forma diferencial en la sepsis neonatal.137,138 La proteómica mide los componentes proteicos liberados después de una infección o inflamación. La proteómica de la sangre del cordón umbilical y del líquido amniótico ha brindado información sobre la respuesta fetal a la inflamación intraamniótica y ha predicho con éxito la EOS con >92 % de precisión.139,140
Proteómica, incluyendo defensina de neutrófilos 1–2, catelicidina, S100A12, S100A8, proapolipoproteína C2, apolipoproteína A-E-H, β-2 microglobulina, haptoglobina, desarginina del líquido amniótico, sangre del cordón umbilical y plasma se encontró que era valiosa en el diagnóstico de EOS y LOS.141–143
La metabolómica mediante imágenes de RM nuclear (RMN) y cromatografía de gases-espectrometría de masas (GC-MS) también se ha investigado en la sepsis de adultos con resultados favorables. 144
El perfil metabolómico urinario de la
neumonía neumocócica del adulto, por ejemplo, ha sido encontrado que es
claramente diferente de virus y otras bacterias
causas de neumonía.145 Esto indica que la evaluación del perfil
urinario de metabolitos puede ser útil para un diagnóstico eficaz y conducir a
tratamiento antibiótico dirigido (target) más rápido. Muestras de orina de
neonatos con sepsis que se evaluaron con H-NMR y GC-MS mostraron un aumento en
glucosa, maltosa, lactato, acetato, cuerpos cetónicos, D-serina y también
normalización de variaciones con tratamiento.146
Un estudio observacional prospectivo que
comparó los perfiles de expresión de todo el genoma de 17 bebés de MBPN con
sepsis bacteriana identificó distintos grupos de patrones de expresión génica en
la sepsis por grampositivos y gramnegativos en comparación con los controles.147
El análisis genómico puede determinar el riesgo de sepsis, la respuesta al
tratamiento y el pronóstico al evaluar variantes genéticas responsables de PRPs,
moléculas de señalización y citoquinas.143,148
Aprendizaje automático.
El aprendizaje automático y la inteligencia artificial
se utilizan cada vez más para clasificar datos transcriptómicos, proteómicos y
metabolómicos para el screening de biomarcadores, el desarrollo de modelos de
pronóstico y para identificación de los pacientes adecuados para terapias
específicas (medicina personalizada). Un ejemplo es el
Pediatric Sepsis Biomarker Risk Model (PERSEVERE), que se desarrolló y validó
como una herramienta de enriquecimiento pronóstico para el shock séptico pediátrico y
para predecir la mortalidad.138,149 Las investigaciones en curso
están investigando la
aplicación del modelo PERSEVERE en el pronóstico de sepsis neonatal.150
Se detectó una variabilidad reducida de la frecuencia cardíaca y
desaceleraciones transitorias en horas o días antes del diagnóstico de
sepsis.151,152 En estos estudios, se informó un diagnóstico temprano de sepsis y
una mortalidad reducida. Recientemente se desarrollaron modelos predictivos que
utilizan el aprendizaje automático. Estos modelos utilizan los signos vitales,
las características clínicas y de laboratorio de los pacientes. Mithal et al.
calculó un score desencadenante de ≥ 5 utilizando eventos de frecuencia cardíaca, frecuencia respiratoria, temperatura, desaturación y bradicardia. Los
autores encontraron que LOS se diagnosticó 43,1 ± 79 h antes de la positividad
del cultivo con sensibilidad 81 %, especificidad 80 %, VPP 57 % y VPN 93 % en 72 pacientes.153
Hallazgos clínicos tales como peso de nacimiento, sexo, uso de catéter y hallazgos de laboratorio tales como parámetros de gases en sangre, CBC también se integraron en modelos de predicción y se encontraron valiosos en el diagnóstico de sepsis.154,155
Nuevas técnicas genéticas.
Los ARN no codificantes (transcriptómica), incluyendo los microARN (miARN) y los ARN circulares, regulan muchas vías de señalización celular, incluyendo la proliferación celular, diferenciación, desarrollo, metabolismo, apoptosis y la producción de citoquinas proinflamatorias.156 Ambos aumentaron (miARN 15-16a-23b-451) y se informó una disminución de la expresión (miRNA 25-129-132-181a-223), mientras que se encontró una sensibilidad 80-89% y especificidad 79-98% en el diagnóstico de sepsis neonatal.157,158 Los exosomas y las trampas extracelulares de neutrófilos liberados durante la inflamación pueden ser objetivos terapéuticos. en el futuro.
Conclusión
La identificación de un biomarcador ideal
para diagnosticar la sepsis neonatal sigue siendo el santo grial, pero los
avances tecnológicos nos han dado una idea de las pruebas prometedoras para el
futuro. Los marcadores inflamatorios tales como PCR y PCT, así como otros índices
hematológicos utilizados actualmente, tienen un valor limitado en los recién
nacidos. Se ha demostrado que las mediciones seriadas de una combinación ideal
de biomarcadores aumentan la precisión diagnóstica, pero siguen siendo costosas
y engorrosas para la práctica clínica. Las herramientas de diagnóstico
molecular, tales como la PCR y la secuenciación, así como la EM, prometen una
detección de enfermedades más rápida y sensible. La tecnología ómica y el
aprendizaje automático pueden proporcionarnos modelos de diagnóstico y
pronóstico que podrían personalizarse para el futuro.
Referencias
Kim, F., Polin, R. A. & Hooven, T. A. Neonatal sepsis. BMJ 371, m3672 (2020).
Shane, A. L., Sánchez, P. J. & Stoll, B. J. Neonatal sepsis. Lancet 390, 1770–1780 (2017).
Cantey, J. B. & Baird, S. D. Ending
the culture of culture-negative sepsis in the neonatal ICU. Pediatrics. 140,
e20170044. https://doi.org/10.1542/peds.2017-
0044 (2017).
Zaidi, A. K. et al. Effect of case management on neonatal mortality due to sepsis and pneumonia. BMC Public Health 11(Suppl. 3), S13 (2011).
Stoll, B. J. & Shane, A. L. in Nelson Textbook of Pediatrics, Vol. 20 (eds Kliegman, R., Stanton, B., St. Geme, J., Schor, N. & Behrman, R.) Ch. 109, 794 (Elsevier, 2013).
Weston, E. J. et al. The burden of invasive early-onset neonatal sepsis in the United States, 2005–2008. Pediatr. Infect. Dis. J. 30, 937–941 (2011).
Osrin, D., Vergnano, S. & Costello, A. Serious bacterial infections in newborn infants in developing countries. Curr. Opin. Infect. Dis. 17, 217–224 (2004).
Oza, S., Lawn, J. E., Hogan, D. R., Mathers, C. & Cousens, S. N. Neonatal cause-ofdeath estimates for the early and late neonatal periods for 194 countries: 2000- 2013. Bull. World Health Organ. 93, 19–28 (2015).
Mukhopadhyay, S. et al. Neurodevelopmental outcomes following neonatal lateonset sepsis and blood culture-negative conditions. Arch. Dis. Child Fetal Neonatal Ed. 106, 467–473. https://doi.org/10.1136/archdischild-2020-320664 (2021).
Mukhopadhyay, S. et al. Impact of
early-onset sepsis and antibiotic use on death or survival with
neurodevelopmental impairment at 2 years of age among
extremely preterm infants. J. Pediatr. 221, 39–46.e35 (2020).
Jardine, L., Davies, M. W. & Faoagali, J. Incubation time required for neonatal blood cultures to become positive. J. Paediatr. Child Health 42, 797–802 (2006).
Sarkar, S., Bhagat, I., DeCristofaro,
J. D., Wiswell, T. E. & Spitzer, A. R. A study of the role of multiple site
blood cultures in the evaluation of neonatal sepsis. J.
Perinatol. 26, 18–22 (2006).
Mukhopadhyay, S., Sengupta, S. & Puopolo, K. M. Challenges and opportunities for antibiotic stewardship among preterm infants. Arch. Dis. Child Fetal Neonatal Ed. 104, F327–F332 (2019).
Taylor, J. E. et al. A quality improvement initiative to reduce central line infection in neonates using checklists. Eur. J. Pediatr. 176, 639–646 (2017).
Brown, J. V. E., Meader, N., Wright, K., Cleminson, J. & McGuire, W. Assessment of C-reactive protein diagnostic test accuracy for late-onset infection in newborn infants: a systematic review and meta-analysis. JAMA Pediatr. 174, 260–268 (2020).
Hedegaard, S. S., Wisborg, K. & Hvas, A. M. Diagnostic utility of biomarkers for neonatal sepsis-a systematic review. Infect. Dis. 47, 117–124 (2015).
Ng, P. C., Ma, T. P. & Lam, H. S. The use of laboratory biomarkers for surveillance, diagnosis and prediction of clinical outcomes in neonatal sepsis and necrotising enterocolitis. Arch. Dis. Child Fetal Neonatal Ed. 100, F448–452 (2015).
Mussap, M., Noto, A., Cibecchini, F. & Fanos, V. The importance of biomarkers in neonatology. Semin. Fetal Neonatal Med. 18, 56–64 (2013).
Celik, I. H. et al. What are the cut-off levels for IL-6 and CRP in neonatal sepsis? J. Clin. Lab. Anal. 24, 407–412 (2010).
Deshmukh, H. S. et al. The microbiota
regulates neutrophil homeostasis and host resistance to Escherichia coli K1
sepsis in neonatal mice. Nat. Med. 20,
524–530 (2014).
Starner, T. D., Agerberth, B.,
Gudmundsson, G. H. & McCray, P. B. Jr. Expression and activity of beta-defensins
and Ll-37 in the developing human lung. J.
Immunol. 174, 1608–1615 (2005)
Zhang, J. P., Chen, C. & Yang, Y.
Changes and clinical significance of toll-like receptor 2 and 4 expression
in neonatal infections. Zhonghua Er Ke Za Zhi 45,
130–133 (2007).
Leaphart, C. L. et al. A critical role
for Tlr4 in the pathogenesis of necrotizing enterocolitis by modulating
intestinal injury and repair. J. Immunol. 179,
4808–4820 (2007).
Cornell, T. T., Wynn, J., Shanley, T.
P., Wheeler, D. S. & Wong, H. R. Mechanisms and regulation of the gene-expression
response to sepsis. Pediatrics 125,
1248–1258 (2010).
Figueras-Aloy, J. et al. Serum soluble
Icam-1, Vcam-1, L-Selectin, and P-Selectin levels as markers of infection
and their relation to clinical severity in neonatal
sepsis. Am. J. Perinatol. 24, 331–338 (2007).
Kingsmore, S. F. et al. Identification of diagnostic biomarkers for infection in premature neonates. Mol. Cell Proteom. 7, 1863–1875 (2008).
van Zoelen, M. A. et al. Role of Toll-like
receptors 2 and 4, and the receptor for advanced glycation end products in
high-mobility group box 1-induced
inflammation in vivo. Shock 31, 280–284 (2009).
Sikora, J. P., Chlebna-Sokol, D. &
Krzyzanska-Oberbek, A. Proinflammatory cytokines (Il-6, Il-8), cytokine
inhibitors (Il-6sr, Stnfrii) and anti-inflammatory
cytokines (Il-10, Il-13) in the pathogenesis of sepsis in newborns and
infants . Arch. Immunol. Ther. Exp. 49, 399–404 (2001).
Cockerill, F. R. 3rd Application of rapid-cycle real-time polymerase chain reaction for diagnostic testing in the clinical microbiology laboratory. Arch. Pathol. Lab Med. 127, 1112–1120 (2003).
Huang, A. H., Yan, J. J. & Wu, J. J. Comparison of five days versus seven days of incubation for detection of positive blood cultures by the Bactec 9240 system. Eur. J. Clin. Microbiol. Infect. Dis. 17, 637–641 (1998).
Schelonka, R. L. et al. Volume of blood required to detect common neonatal pathogens. J. Pediatr. 129, 275–278 (1996).
Cotten, C. M. Adverse consequences of neonatal antibiotic exposure. Curr. Opin. Pediatr. 28, 141–149 (2016).
Greenberg, R. G. et al. Prolonged duration of early antibiotic therapy in extremely premature infants. Pediatr. Res. 85, 994–1000 (2019).
Bouza, E., Sousa, D., Rodríguez-Créixems, M., Lechuz, J. G. & Muñoz, P. Is the volume of blood cultured still a significant factor in the diagnosis of bloodstream infections? J. Clin. Microbiol. 45, 2765–2769 (2007).
Mukhopadhyay, S. & Puopolo, K. M.
Relevance of neonatal anaerobic blood cultures: new information for an old
question. J. Pediatr. Infect. Dis. Soc. 7,
e126–e127 (2018).
Messbarger, N. & Neemann, K. Role of anaerobic blood cultures in neonatal bacteremia. J. Pediatr. Infect. Dis. Soc. 7, e65–e69 (2018).
Yaacobi, N., Bar-Meir, M., Shchors, I.
& Bromiker, R. A prospective controlled trial of the optimal volume for
neonatal blood cultures. Pediatr. Infect. Dis. J. 34,
351–354 (2015).
Créixems, M. R. et al. Use of anaerobically incubated media to increase yield of positive blood cultures in children. Pediatr. Infect. Dis. J. 21, 443–446 (2002).
Dunne, W. M. Jr., Tillman, J. & Havens, P. L. Assessing the need for anaerobic medium for the recovery of clinically significant blood culture isolates in children . Pediatr. Infect. Dis. J. 13, 203–206 (1994).
Kothari, A., Morgan, M. & Haake, D. A. Emerging technologies for rapid identification of bloodstream pathogens. Clin. Infect. Dis. 59, 272–278 (2014).
Calderaro, A. et al. Comparison of peptide nucleic acid fluorescence in situ hybridization assays with culture-based matrix-assisted laser desorption/ionization-time of flight mass spectrometry for the identification of bacteria and yeasts from blood cultures and cerebrospinal fluid cultures. Clin. Microbiol. Infect. 20, O468–O475 (2014).
Deck, M. K. et al. Multicenter evaluation of the staphylococcus quickfish method for simultaneous identification of Staphylococcus aureus and coagulase-negative Staphylococci directly from blood culture bottles in less than 30 min. J. Clin. Microbiol. 50, 1994–1998 (2012).
Forrest, G. N. et al. Impact of rapid
in situ hybridization testing on coagulasenegative staphylococci positive
blood cultures. J. Antimicrobial Chemother. 58,
154–158 (2006).
Ly, T., Gulia, J., Pyrgos, V., Waga, M. & Shoham, S. Impact upon clinical outcomes of translation of PNA fish-generated laboratory data from the clinical microbiology bench to bedside in real time. Ther. Clin. Risk Manag. 4, 637–640 (2008).
Neely, L. A. et al. T2 magnetic resonance enables nanoparticle-mediated rapid detection of candidemia in whole blood. Sci. Transl. Med. 5, 182ra154 (2013).
Mancini, N. et al. The era of molecular and other non-culture-based methods in diagnosis of sepsis. Clin. Microbiol Rev. 23, 235–251 (2010).
Haag, H., Locher, F. & Nolte, O.
Molecular diagnosis of microbial aetiologies using Sepsitest™ in the daily
routine of a diagnostic laboratory. Diagn. Microbiol.
Infect. Dis. 76, 413–418 (2013).
Straub, J. et al. Diagnostic accuracy
of the Roche Septifast Pcr System for the rapid detection of blood pathogens
in neonatal sepsis-a prospective clinical
trial. PLoS ONE 12, e0187688 (2017).
Liu, C. L. et al. Comparison of 16s rRNA gene PCR and blood culture for diagnosi s of neonatal sepsis. Arch. Pediatr. 21, 162–169 (2014).
Reier-Nilsen, T., Farstad, T., Nakstad, B., Lauvrak, V. & Steinbakk, M. Comparison of broad range 16s rDNA PCR and conventional blood culture for diagnosis of sepsis in the newborn: a case control study. BMC Pediatr. 9, 5 (2009).
Iroh Tam, P. Y. & Bendel, C. M. Diagnostics for neonatal sepsis: current approaches and future directions. Pediatr. Res. 82, 574–583 (2017).
Pammi, M., Flores, A., Versalovic, J.
& Leeflang, M. M. Molecular assays for the diagnosis of sepsis in neonates.
Cochrane Database Syst. Rev. 2, CD011926
(2017).
Arnon, S. & Litmanovitz, I. Diagnostic tests in neonatal sepsis. Curr. Opin. Infect. Dis. 21, 223–227 (2008).
Schmutz, N., Henry, E., Jopling, J. &
Christensen, R. D. Expected ranges for blood neutrophil concentrations of
neonates: the Manroe and Mouzinho Charts
Revisited. J. Perinatol. 28, 275–281 (2008).
Manroe, B. L., Weinberg, A. G., Rosenfeld, C. R. & Browne, R. The neonatal blood count in health and disease. I. Reference values for neutrophilic cells. J. Pediatr. 95, 89–98 (1979).
Sharma, D., Farahbakhsh, N., Shastri, S. & Sharma, P. Biomarkers for diagnosis of neonatal sepsis: a literature review. J. Matern. Fetal Neonatal Med. 31, 1646–1659 (2018).
Newman, T. B., Puopolo, K. M., Wi, S.,
Draper, D. & Escobar, G. J. Interpreting complete blood counts soon after
birth in newborns at risk for sepsis. Pediatrics
126, 903–909 (2010).
Can, E., Hamilcikan, S. & Can, C. The value of neutrophil to lymphocyte ratio and platelet to lymphocyte ratio for detecting early-onset neonatal sepsis. J. Pediatr. Hematol. Oncol. 40, e229–e232 (2018).
Arcagok, B. C. & Karabulut, B.
Platelet to lymphocyte ratio in neonates: a predictor of early onset
neonatal sepsis. Mediterr. J. Hematol. Infect. Dis. 11,
e2019055 (2019).
Gandhi, P. & Kondekar, S. A review of the different haematological parameters and biomarkers used for diagnosis of neonatal sepsis. EMJ Hematol. 7, 85–92 (2019).
Celik, I. H. et al. Automated
determination of neutrophil vcs parameters in diagnosis and treatment
efficacy of neonatal sepsis. Pediatr. Res. 71, 121–125
(2012).
Celik, I. H. et al. The value of delta neutrophil index in neonatal sepsis diagnosis, follow-up and mortality prediction. Early Hum. Dev. 131, 6–9 (2019).
Murphy, K. & Weiner, J. Use of leukocyte counts in evaluation of early-onset neonatal sepsis. Pediatr. Infect. Dis. J. 31, 16–19 (2012).
Ellahony, D. M., El-Mekkawy, M. S. & Farag, M. M. A study of red cell distribution width in neonatal sepsis. Pediatr. Emerg. Care 36, 378–383 (2020).
Han, Y. Q. et al. Red blood cell
distribution width predicts long-term outcomes in sepsis patients admitted
to the intensive care unit. Clin. Chim. Acta 487,
112–116 (2018).
Martin, S. L. et al. Red cell distribution width and its association with mortality in neonatal sepsis. J. Matern. Fetal Neonatal Med. 32, 1925–1930 (2019).
Dogan, P. & Guney Varal, I. Red cell distribution width as a predictor of lateonset gram-negative sepsis. Pediatr. Int. 62, 341–346 (2020).
Spector, S. A., Ticknor, W. & Grossman,
M. Study of the usefulness of clinical and hematologic findings in the
diagnosis of neonatal bacterial infections. Clin.
Pediatr. 20, 385–392 (1981).
Wang, J. et al. Diagnostic value of mean platelet volume for neonatal sepsis: a systematic review and meta-analysis. Medicine 99, e21649 (2020).
Oncel, M. Y. et al. Mean platelet volume in neonatal sepsis. J. Clin. Lab Anal. 26, 493–496 (2012).
Aydemir, C., Aydemir, H., Kokturk, F., Kulah, C. & Mungan, A. G. The cut-off levels of procalcitonin and c-reactive protein and the kinetics of mean platelet volume in preterm neonates with sepsis. BMC Pediatr. 18, 253 (2018).
Eschborn, S. & Weitkamp, J. H. Procalcitonin versus c-reactive protein: review of kinetics and performance for diagnosis of neonatal sepsis. J. Perinatol. 39, 893–903 (2019).
Celik, I. H., Demirel, G., Canpolat, F. E., Erdeve, O. & Dilmen, U. Inflammatory responses to hepatitis B virus vaccine in healthy term infants. Eur. J. Pediatr. 172, 839–842 (2013).
Stocker, M., Hop, W. C. & van Rossum, A. M. Neonatal Procalcitonin Intervention Study (Neopins): effect of procalcitonin-guided decision making on duration of antibiotic therapy in suspected neonatal early-onset sepsis: a Multi-Centre Randomized Superiority and Non-Inferiority Intervention Study. BMC Pediatr. 10, 89 (2010).
75. Balog, A., Ocsovszki, I. & Mándi, Y. Flow cytometric analysis of procalcitonin expression in human monocytes and granulocytes. Immunol. Lett. 84, 199–203 (2002).
Christ-Crain, M. & Müller, B. Procalcitonin in bacterial infections-hype, hope, more or less? Swiss Med. Wkly 135, 451–460 (2005).
Ruan, L. et al. The combination of procalcitonin and C-reactive protein or presepsin alone improves the accuracy of diagnosis of neonatal sepsis: a metaanalysis and systematic review. Crit. Care 22, 316 (2018).
Altunhan, H., Annagür, A., Örs, R. &
Mehmetoğlu, I. Procalcitonin measurement at 24 h of age may be helpful in
the prompt diagnosis of early-onset neonatal
sepsis. Int. J. Infect. Dis. 15, e854–858 (2011).
Stocker, M. et al. Procalcitonin-guided decision making for duration of antibiotic therapy in neonates with suspected early-onset sepsis: a Multicentre, Randomised Controlled Trial (Neopins). Lancet 390, 871–881 (2017).
Vouloumanou, E. K., Plessa, E., Karageorgopoulos, D. E., Mantadakis, E. & Falagas, M. E. Serum procalcitonin as a diagnostic marker for neonatal sepsis: a systematic review and meta-analysis. Intens. Care Med. 37, 747–762 (2011).
Aloisio, E., Dolci, A. & Panteghini, M. Procalcitonin: between evidence and critical issues. Clin. Chim. Acta 496, 7–12 (2019).
Frerot, A. et al. Cord blood procalcitonin level and early-onset sepsis in extremely preterm infants. Eur. J. Clin. Microbiol Infect. Dis. 38, 1651–1657 (2019).
Canpolat, F. E., Yigit, S., Korkmaz,
A., Yurdakok, M. & Tekinalp, G. Procalcitonin versus CRP as an early
indicator of fetal infection in preterm premature rupture
of membranes. Turk. J. Pediatr. 53, 180–186 (2011).
Lannergård, A., Friman, G., Ewald, U.,
Lind, L. & Larsson, A. Serum amyloid A (SAA) protein and high-sensitivity
c-reactive protein (hsCRP) in healthy newborn
infants and healthy young through elderly adults. Acta Paediatr. 94,
1198–1202 (2005).
Chauhan, N., Tiwari, S. & Jain, U. Potential biomarkers for effective screening of neonatal sepsis infections: an overview. Microb. Pathog. 107, 234–242 (2017).
Cetinkaya, M., Ozkan, H., Köksal, N., Celebi, S. & Hacimustafaoğlu, M. Comparison of serum amyloid A concentrations with those of C-reactive protein and procalcitonin in diagnosis and follow-up of neonatal sepsis in premature infants. J. Perinatol. 29, 225–231 (2009).
Yuan, H. et al. Diagnosis value of the serum amyloid a test in neonatal sepsis: a meta-analysis. Biomed. Res. Int. 2013, 520294 (2013).
Hinson, J. P., Kapas, S. & Smith, D. M. Adrenomedullin, a multifunctional regulatory peptide. Endocr. Rev. 21, 138–167 (2000).
Oncel, M. Y. et al. Proadrenomedullin as a prognostic marker in neonatal sepsis. Pediatr. Res. 72, 507–512 (2012).
Fahmey, S. S., Mostafa, H., Elhafeez,
N. A. & Hussain, H. Diagnostic and prognostic value of proadrenomedullin in
neonatal sepsis. Korean J. Pediatr. 61,
156–159 (2018).
Cekmez, F. et al. Diagnostic value of resistin and visfatin, in comparison with c-reactive protein, procalcitonin and interleukin-6 in neonatal sepsis. Eur. Cytokine Netw. 22, 113–117 (2011).
Aliefendioglu, D., Gursoy, T., Caglayan, O., Aktas, A. & Ovali, F. Can resistin be a new indicator of neonatal sepsis? Pediatr. Neonatol. 55, 53–57 (2014).
Khattab, A. A., El-Mekkawy, M. S.,
Helwa, M. A. & Omar, E. S. Utility of serum resistin in the diagnosis of
neonatal sepsis and prediction of disease severity in
term and late preterm infants. J. Perinat. Med. 46, 919–925 (2018).
Wu, T. W. et al. The utility of serum hepcidin as a biomarker for late-onset neonatal sepsis. J. Pediatr. 162, 67–71 (2013).
Rao, L. et al. Progranulin as a novel biomarker in diagnosis of early-onset neonatal sepsis. Cytokine 128, 155000 (2020).
Badr, H. S., El-Gendy, F. M. & Helwa,
M. A. Serum stromal-derived-factor-1 (Cxcl12) and its alpha chemokine
receptor (Cxcr4) as biomarkers in neonatal
sepsis. J. Matern. Fetal Neonatal Med. 31, 2209–2215 (2018).
Zonda, G. I. et al. Endocan - a potential diagnostic marker for early onset sepsis in neonates. J. Infect. Dev. Ctries 13, 311–317 (2019).
Fahmey, S. S. & Mostafa, N. Pentraxin 3 as a novel diagnostic marker in neonatal sepsis. J. Neonatal Perinat. Med. 12, 437–442 (2019).
Edgar, J. D., Gabriel, V., Gallimore,
J. R., McMillan, S. A. & Grant, J. A prospective study of the sensitivity,
specificity and diagnostic performance of soluble
intercellular adhesion molecule 1, highly sensitive c-reactive protein,
soluble E-selectin and serum amyloid A in the diagnosis of neonatal
infection. BMC
Pediatr. 10, 22 (2010).
Machado, J. R. et al. Neonatal sepsis and inflammatory mediators. Mediators Inflamm. 2014, 269681 (2014).
Buck, C., Bundschu, J., Gallati, H., Bartmann, P. & Pohlandt, F. Interleukin-6: a sensitive parameter for the early diagnosis of neonatal bacterial infection. Pediatrics 93, 54–58 (1994).
Sun, B. et al. A meta-analysis of interleukin-6 as a valid and accurate index in diagnosing early neonatal sepsis. Int. Wound J. 16, 527–533 (2019).
Bender, L. et al. Early and late markers for the detection of early-onset neonatal sepsis. Dan. Med. Bull. 55, 219–223 (2008).
Cortes, J. S. et al. Interleukin-6 as a biomarker of early-onset neonatal sepsis. Am. J. Perinatol. 38, e338–e346. https://doi.org/10.1055/s-0040-1710010 (2020).
Kurul, S. et al. Association of
inflammatory biomarkers with subsequent clinical course in suspected late
onset sepsis in preterm neonates. Crit. Care 25, 12
(2021).
Ye, Q., Du, L. Z., Shao, W. X. & Shang, S. Q. Utility of cytokines to predict neonatal sepsis. Pediatr. Res. 81, 616–621 (2017).
Celik, I. H. et al. The role of serum interleukin-6 and C-reactive protein levels for differentiating aetiology of neonatal sepsis. Arch. Argent. Pediatr 113, 534–537 (2015).
Raynor, L. L. et al. Cytokine screening identifies NICU patients with gramnegative bacteremia. Pediatr. Res. 71, 261–266 (2012).
Zhou, M., Cheng, S., Yu, J. & Lu, Q. Interleukin-8 for diagnosis of neonatal sepsis: a meta-analysis. PLoS ONE 10, e0127170 (2015).
Beutler, B. A., Milsark, I. W. &
Cerami, A. Cachectin/tumor necrosis factor: production, distribution, and
metabolic fate in vivo. J. Immunol. 135, 3972–3977
(1985).
Lv, B. et al. Tumor necrosis factor-alpha as a diagnostic marker for neonatal sepsis: a meta-analysis. Scientific World J. 2014, 471463 (2014).
Delanghe, J. R. & Speeckaert, M. M. Translational research and biomarkers in neonatal sepsis. Clin. Chim. Acta 451, 46–64 (2015).
Ganesan, P., Shanmugam, P., Sattar, S. B. & Shankar, S. L. Evaluation of IL-6, CRP and Hs-Crp as early markers of neonatal sepsis. J. Clin. Diagn. Res. 10, Dc13–17 (2016).
Venet, F., Lepape, A. & Monneret, G. Clinical review: flow cytometry perspectives in the ICU - from diagnosis of infection to monitoring of injury-induced immune dysfunctions. Crit. Care 15, 231 (2011).
Mazzucchelli, I. et al. Diagnostic performance of triggering receptor expressed on myeloid cells-1 and Cd64 index as markers of sepsis in preterm newborns. Pediatr. Crit. Care Med. 14, 178–182 (2013).
Du, J. et al. Diagnostic utility of neutrophil Cd64 as a marker for early-onset sepsis in preterm neonates. PLoS ONE 9, e102647 (2014).
Pugni, L. et al. Presepsin (soluble Cd14 subtype): reference ranges of a new sepsis marker in term and preterm neonates. PLoS ONE 10, e0146020 (2015).
Shi, J., Tang, J. & Chen, D. Meta-analysis of diagnostic accuracy of neutrophil Cd64 for neonatal sepsis. Ital. J. Pediatr. 42, 57 (2016).
Dilli, D., Oguz, S. S., Dilmen, U., Koker, M. Y. & Kizilgun, M. Predictive values of neutrophil Cd64 expression compared with interleukin-6 and C-reactive protein in early diagnosis of neonatal sepsis. J. Clin. Lab Anal. 24, 363–370 (2010).
Streimish, I. et al. Neutrophil Cd64 with hematologic criteria for diagnosis of neonatal sepsis. Am. J. Perinatol. 31, 21–30 (2014).
Qiu, X. et al. Is neutrophil Cd11b a
special marker for the early diagnosis of sepsis in neonates? A systematic
review and meta-analysis. BMJ Open 9,
e025222 (2019).
Bellos, I. et al. The diagnostic accuracy of presepsin in neonatal sepsis: a metaanalysis. Eur. J. Pediatr. 177, 625–632 (2018).
Blanco, A. et al. Serum levels of Cd14 in neonatal sepsis by gram-positive and gram-negative bacteria. Acta Paediatr. 85, 728–732 (1996).
Seliem, W., & Sultan, A. M. Presepsin as a predictor of early onset neonatal sepsis in the umbilical cord blood of premature infants with premature rupture of membranes. Pediatr. Int. 60, 428–432 (2018).
Ahmed, A. M. et al. Serum biomarkers
for the early detection of the early-onset neonatal sepsis: a single-center
prospective Study. Adv. Neonatal Care 19,
E26–E32 (2019).
Adly, A. A., Ismail, E. A., Andrawes,
N. G. & El-Saadany, M. A. Circulating soluble triggering receptor expressed
on myeloid cells-1 (Strem-1) as diagnostic and
prognostic marker in neonatal sepsis. Cytokine 65, 184–191 (2014).
Alkan Ozdemir, S., Ozer, E. A., Ilhan,
O., Sutcuoglu, S. & Tatli, M. Diagnostic value of urine soluble triggering
receptor expressed on myeloid cells (Strem-1) for
late-onset neonatal sepsis in infected preterm neonates. J. Int. Med. Res.
46, 1606–1616 (2018).
Bellos, I. et al. Soluble Trem-1 as a predictive factor of neonatal sepsis: a metaanalysis. Inflamm. Res. 67, 571–578 (2018).
Dolin, H. H., Papadimos, T. J.,
Stepkowski, S., Chen, X. & Pan, Z. K. A novel combination of biomarkers to
herald the onset of sepsis prior to the manifestation
of symptoms. Shock 49, 364–370 (2018).
Gilfillan, M. & Bhandari, V. Biomarkers for the diagnosis of neonatal sepsis and necrotizing enterocolitis: clinical practice guidelines. Early Hum. Dev. 105, 25–33 (2017).
Luethy, P. M. & Johnson, J. K. The use of matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF MS) for the identification of pathogens causing sepsis. J. Appl. Lab Med. 3, 675–685 (2019).
Scott, J. S., Sterling, S. A., To, H., Seals, S. R. & Jones, A. E. Diagnostic performance of matrix-assisted laser desorption ionisation time-of-flight mass spectrometry in blood bacterial infections: a systematic review and meta-analysis. Infect. Dis. 48, 530–536 (2016).
Ruiz-Aragón, J. et al. Direct bacterial identification from positive blood cultures using matrix-assisted laser desorption/ionization time-of-flight (MALDI-TOF) mass spectrometry: a systematic review and meta-analysis. Enferm. Infecc. Microbiol Clin. 36, 484–492 (2018).
Guamán, A. V. et al. Rapid detection of sepsis in rats through volatile organic compounds in breath. J. Chromatogr. B 881-882, 76–82 (2012).
Fink, T. et al. Volatile organic compounds during inflammation and sepsis in rats: a potential breath test using ion-mobility spectrometry. Anesthesiology 122, 117–126 (2015).
Oeschger, T., McCloskey, D., Kopparthy, V., Singh, A. & Erickson, D. Point of care technologies for sepsis diagnosis and treatment. Lab Chip 19, 728–737 (2019).
Abbas, M. & El-Manzalawy, Y. Machine learning based refined differential gene expression analysis of pediatric sepsis. BMC Med. Genomics 13, 122 (2020)
Wong, H. R. et al. Prospective clinical testing and experimental validation of the Pediatric Sepsis Biomarker Risk Model. Sci. Transl. Med. 11, eaax9000. https://doi.org/10.1126/scitranslmed.aax9000 (2019).
Buhimschi, C. S. et al. Proteomic profiling of the amniotic fluid to detect inflammation, infection, and neonatal sepsis. PLoS Med. 4, e18 (2007).
Buhimschi, C. S. et al. Using proteomics in perinatal and neonatal sepsis: hopes and challenges for the future. Curr. Opin. Infect. Dis. 22, 235–243 (2009).
Buhimschi, I. A. & Buhimschi, C. S. The role of proteomics in the diagnosis of chorioamnionitis and early-onset neonatal sepsis. Clin. Perinatol. 37, 355–374 (2010).
Ho, J. et al. Pathological role and diagnostic value of endogenous host defense peptides in adult and neonatal sepsis: a systematic review. Shock 47, 673–679 (2017).
Mangioni, D. et al. Toward rapid sepsis diagnosis and patient stratification: What’s new from microbiology and omics science. J. Infect. Dis. 221, 1039–1047 (2020).
Schmerler, D. et al. Targeted metabolomics for discrimination of systemic inflammatory disorders in critically ill patients. J. Lipid Res. 53, 1369–1375 (2012)
Slupsky, C. M. et al. Pneumococcal pneumonia: potential for diagnosis through a urinary metabolic profile. J. Proteome Res. 8, 5550–5558 (2009).
Fanos, V. et al. Urinary (1)H-Nmr and Gc-Ms metabolomics predicts early and late onset neonatal sepsis. Early Hum. Dev. 90(Suppl. 1), S78–83 (2014).
Cernada, M. et al. Genome-wide expression profiles in very low birth weight infants with neonatal sepsis. Pediatrics 133, e1203–1211 (2014).
Lu, H. et al. Host genetic variants in sepsis risk: a field synopsis and metaanalysis. Crit. Care 23, 26 (2019).
Wong, H. R. et al. Biomarkers for estimating risk of hospital mortality and longterm quality-of-life morbidity after surviving pediatric septic shock: a secondary analysis of the life after pediatric sepsis evaluation investigation. Pediatr. Crit. Care Med. 22, 8–15 (2021).
Gharaibeh, F. A., Lahni, P. M., Alder, M. N. & Wong, H. R. P. A. S. in Pediatric Academic Societies Meeting.
Moorman, J. R. et al. Mortality reduction by heart rate characteristic monitoring in very low birth weight neonates: a randomized trial. J. Pediatr. 159, 900–906. e901 (2011).
Griffin, M. P. et al. Abnormal heart rate characteristics preceding neonatal sepsis and sepsis-like illness. Pediatr. Res. 53, 920–926 (2003).
Mithal, L. B. et al. Vital signs analysis algorithm detects inflammatory response in premature infants with late onset sepsis and necrotizing enterocolitis. Early Hum. Dev. 117, 83–89 (2018).
Helguera-Repetto, A. C. et al. Neonatal sepsis diagnosis decision-making based on artificial neural networks. Front. Pediatr. 8, 525 (2020).
Song, W. et al. A predictive model
based on machine learning for the early detection of late-onset neonatal
sepsis: development and observational study.
JMIR Med. Inf. 8, e15965 (2020).
Fatmi, A. et al. Mirna-23b as a biomarker of culture-positive neonatal sepsis. Mol. Med. 26, 94 (2020).
Liu, G., Liu, W. & Guo, J. Clinical significance of Mir-181a in patients with neonatal sepsis and its regulatory role in the lipopolysaccharide-induced inflammatory response. Exp. Ther. Med. 19, 1977–1983 (2020).
El-Hefnawy, S. M. et al. Biochemical and molecular study on serum miRNA-16A and miRNA- 451 as neonatal sepsis biomarkers. Biochem. Biophys. Rep. 25, 100915 (2021).