Nutrición parenteral precoz
Julio 2015
Aporte inicial de aminoácidos influencia homeostasis de Ca y P en prematuros - Es tiempo de cambiar la composición de la nutrición parenteral precoz.
Francesco Bonsante. PLOS ONE | www.plosone.org August 2013
I.- Introducción
Guías de nutrición recientes recomiendan la introducción precoz de nutrición parenteral (NP)"agresiva" para el prematuro, con el fin de evitar el catabolismo celular y promover el crecimiento extra-uterino (1-4). Existe evidencia actual de que el balance de agua y electrolitos, junto con la homeostasis de micronutrientes, pueden estar influídos por NP agresiva precoz (5,6).
En investigaciones anteriores se ha mostrado que un mayor aporte precoz de aminoácidos (AA) puede prevenir la hiperpotasemia no oligúrica en neonatos de muy bajo peso al nacer mediante la inhibición del catabolismo celular y promover el crecimiento 7.
El metabolismo del fósforo y su concentración plasmática también pueden ser influenciados por este nuevo enfoque nutricional. El contenido de fosfato es muy abundante en la célula, ya que representa el principal anión en el espacio intracelular y él entra en la composición de ácidos nucleicos, ATP y membrana celular. El rol del fosfato en el desarrollo óseo y mineralización y también en el crecimiento celular, puede provocar variaciones dramáticas en su concentración en suero durante la NP agresiva precoz.
Recientes observaciones clínicas apoyan esta hipótesis. Mizumoto et al. 8 han observado un cuadro severo de hipofosfatemia e hipopotasemia provocado por NP agresiva precoz en un prematuro de extremo bajo peso de nacimiento (EBPN). En una pequeña cohorte retrospectiva, Ichikawa et al. han demostrado que una mayor administración parenteral de AA facilitó un cuadro de hipofosfatemia e hipercalcemia en prematuros de EBPN al final de la primera semana de vida 9.
En ambos estudios, los niveles de fosfato en plasma en los niños que recibieron NP se asoció inversamente con elaporte de AA. Un estudio publicado por Moltu y cols en 2012 ha demostrado además que el aumento de la alimentación en niños de muy bajo peso al nacer puede causar desequilibrios de electrolitos (hipopotasemia, hipofosfatemia e hipercalcemia) durante la primera semana de vida 10.
De hecho, las perturbaciones de concentración de fosfato también causan variaciones en los niveles plasmáticos y excreción urinaria de calcio , debido a las interacciones metabólicas de estos dos micronutrientes durante el proceso de resorción y formación ósea.
El presente estudio es parte de una
investigación prospectiva realizada con el objetivo de evaluar la relación entre
la homeostasis de líquidos y electrolitos y el aporte nutricional en una cohorte
de niños prematuros, como ya se ha descrito 11.
Parte de la información acerca de la influencia del aporte de proteínas y
calorías sobre los compartimentos de líquidos y balances de sodio y potasio ya
ha sido publicada en un artículo anterior 11.
Los objetivos de este estudio son los
siguientes:
En primer lugar, evaluar la influencia de la nutrición precoz en la homeostasis
del calcio y fosfato en prematuros; En segundo lugar, crear una herramienta de
cálculo simple, con el fin de estimar la cantidad óptima de fósforo que debe
añadirse en las bolsas de NP de acuerdo con el aporte de AA administrado.
II.- Métodos
Diseño y población de estudio
Todos los prematuros nacidos con menos de 33 semanas de EG y hospitalizados dentro de 6 horas de vida en la UCIN del Dijon University Hospital fueron elegibles.
Prescripción nutricional
Se administró NP por línea venosa central ó periférica se administró de acuerdo a la decisión clínica. En ambos casos, NP fue administrada por formulaciones individualizadas preparadas en la unidad ó por bolsas de lotes producidos en forma estandarizada , como ya se mostró en un reporte previo 7. En caso de NP parcial el aporte nutricional intravenoso estaba limitado por la osmolaridad de la solución.
Alimentación enteral mínima con leche humana se inició en el primer día de vida y continuó durante al menos 4 días en prematuros con NP total. Cuando se administró NP parcial, la nutrición enteral se inició el día 1 a 20 ml / kg / día y se aumentó diariamente durante la semana.
Aporte de Aminoácidos, Calcio (Ca) y fósforo (P)
El aporte de AA (Primene 10%, Baxter) se inició en el día uno y se incrementó diariamente hasta 3,5 g / kg al final de la primera semana en el procedimiento estandarizado. Cuando la NP era individualizada, la cantidad inicial y tasa de aumento de AA se decidió por el médico tratante en base a un protocolo escrito disponible en la unidad el que sugirió el día de vida para inicio de aporte de cada nutriente y energía.
La infusión de Ca (gluconato de Ca 10%) se inició en primer día de vida a 40 - 50 mg / kg / día.
La infusión de P se inició en 2° ó 3er día, con amplias variaciones entre los recién nacidos, dependiendo del médico tratante.
Recolección de datos
Sodio , potasio, Ca , P, CO2 total, urea y creatinina plasmáticos se determinaron diariamente durante 7 días. La primera muestra de sangre se obtuvo alrededor de 12 horas de vida. Se calculó Diuresis diaria y se recolectó orina de 8 horas consecutivas, empezando 4 horas antes de la toma de muestras de sangre utilizando bolsa de plástico. Se analizó en orina las concentraciones de sodio, potasio, Ca, urea y creatinina. Fluído, energía e ingesta de nutrientes se registraron diariamente. La ingesta de leche humana oral se consideró en cálculos de aporte de fluídos y nutrientes. Se midió Electrolitos en plasma y orina. Balance de Ca fue expresado en mg / kg / día y se calcula como la diferencia entre ingesta y excreción urinaria diaria.
Statistics
En primer lugar, la asociación de calcemia, fosfemia y balance de Ca con variables perinatales y el aporte de energía, AA, Ca y P, se analizó utilizando el análisis de un factor de varianza. Las variables perinatales ingresadas en el modelo fueron : peso al nacer, edad gestacional, sexo, pequeño para edad gestacional, corticosteroides prenatales, cesárea, edad postnatal y síndrome de distress respiratorio. Variables significativas en un valor P 0,10 en el análisis univariante se introdujeron en un análisis de selección de varianza. Luego, los niños fueron divididos en tres grupos, de acuerdo con nivel promedio de ingesta de AA durante la semana: baja ingesta de AA: <1.5 g / kg / día (LAA); ingesta media AA: 1,5-2 g / kg / d (MAA); alta ingesta de AA : > 2 g / kg / día (HAA).
Calcemia, fosfatemia y balance de Ca fueron comparados dentro de los tres grupos. También se evaluó el riesgo crudo para trastorno de Ca y P. Los datos de variables continuas se expresaron como media ± desviación estándar. Las diferencias entre los grupos se estudiaron mediante análisis de test de varianza y los resultados se ajustaron para EG con el análisis de test de covarianza. Se utilizaron procedimientos de regresión lineal para correlacionar el déficit acumulado calculado en aporte de P con los niveles plasmáticos de Ca y P.
Modelo de ingesta óptima de fósforo
Un modelo teórico para requerimiento de P se elaboró como sigue :
Relación estimada de masa de Ca y P en hueso, basado en la composición de hidroxiapatita: P (mg) = Ca (mg) / 2,15
Relación estimada de nitrógeno (AA) y P en la célula de crecimiento rápido: P (mg) = AA (g) x 12.3
Ingesta mínima estimada de AA para obtener un balance positivo de nitrógeno: AA = 1,3 g / kg / d
Retención estimada de AA : AA = 80% de la ingesta de AA (excediendo la ingesta mínima de AA)
Fórmula de cálculo: necesidad P = Ca admisión / 2,15 + (ingesta de AA - 1,3) x 0.8 x 12.3
Necesidad P se expresa en mg / kg / d; La ingesta de Ca se expresa en mg / kg / d; La ingesta de AA se expresa en g / kg / d.
La fórmula se basa en la ingesta total. No toma en cuenta la tasa de absorción enteral de nutrientes.
Prueba del Modelo.
La necesidad estimada de P se calculó para cada día de la primera semana. A continuación, se evaluó el déficit de P diariamente restando la ingesta real de P de la necesidad teórica. Se calculó entonces el déficit acumulado de ingesta de P desde el nacimiento y se correlacionó con los niveles plasmáticos de Ca y P. Se realizó un segundo análisis de regresión lineal ajustando los niveles plasmáticos de Ca y P diariamente para su nivel en el primer día de vida en cada prematuro.
Resultados
Se incluyeron 154 niños. Se realizaron 813 determinaciones plasmáticas de Ca y 436 determinaciones plasmáticas de P. En total, se obtuvieron 465 muestras de orina de Ca.
La Tabla 1 muestra el análisis multivariante. El principal factor independiente que influye calcemia y fosfatemia era ingesta AA. También la ingesta de fósforo fue un importante factor independiente para ambos niveles plasmáticos de Ca y P.
Las características antenatales, postnatales y la ingesta nutricional para los tres grupos se resumen en Tabla 2. El grupo HAA era similar al grupo MAA con respecto a PN y EG pero difería del grupo LAA. La ingesta de AA era diferente, por definición, entre los grupos, al igual que el aporte de energía. La ingesta de Ca y P no fueron muy diferentes en los grupos.
El análisis de grupo confirmó la influencia de la ingesta de AA en la homeostasis de Ca. Calcemia fue significativamente mayor en el grupo HAA como fue la incidencia de hipercalcemia grave (Ca > 2,8 mmol / L). La calciuria era muy importante en el grupo HAA al final de la semana. A pesar de estos altos niveles de calciuria, el balance de Ca se mantuvo positivo en todo momento en todos los grupos. Fosfatemia fue fuertemente influenciada por la nutrición precoz , con niveles plasmáticos muy bajos en el grupo HAA y un riesgo significativo de hipofosfatemia (P < 1 mmol / L) (Tabla 3).

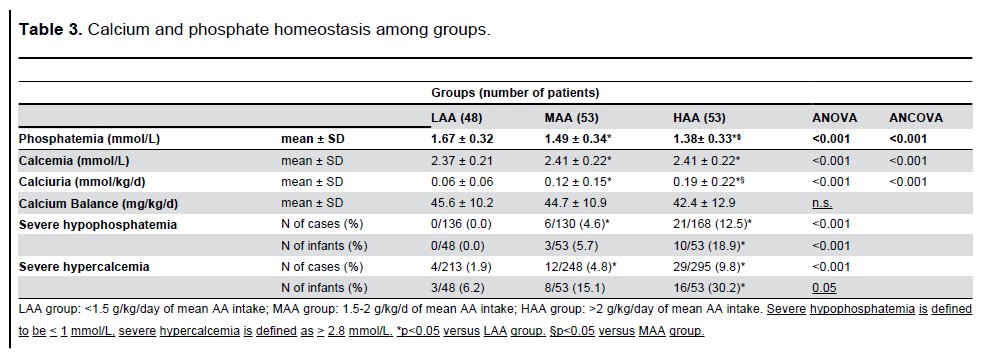
La figura 1 muestra la evolución día a día del Ca y Pplasmático con una clara relación inversa entre los dos iones.
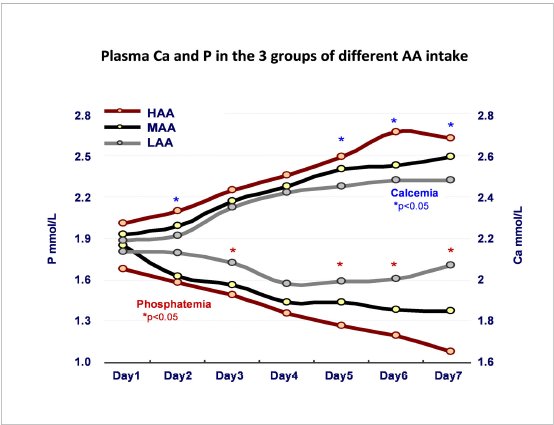
La Figura 2 presenta la calciuria diariamente.
La Tabla 2 muestra la necesidad estimada de P y el déficit de P para los 3 grupos.

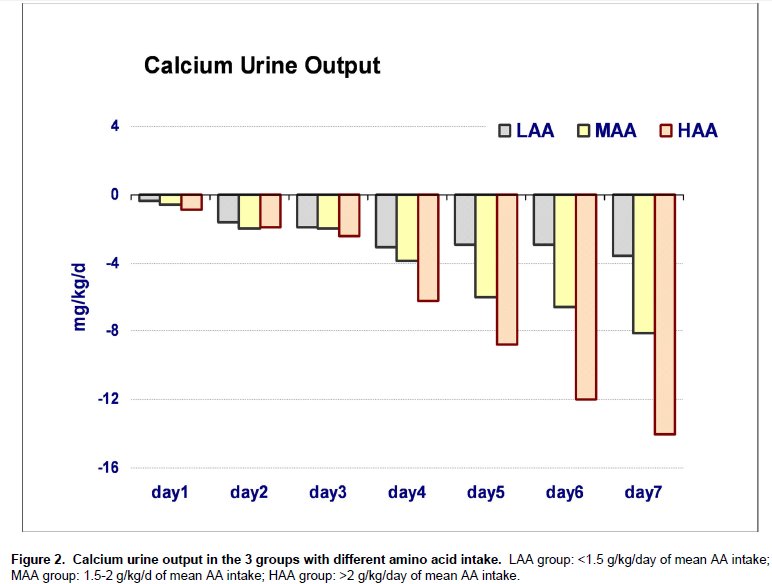
Los resultados de los procedimientos de regresión lineal entre el déficit acumulado estimado de P y los niveles plasmáticos de fosfato y calcio se expresan en la Tabla 4 y gráficamente se muestran en Figura 3.
Discusión
El enfoque moderno de nutrición del recién
nacido prematuro se basa en iniciar la alimentación tan pronto como sea posible
después del nacimiento suministrando un flujo continuo parenteral de AA y
energía (nutrición parenteral "agresiva" precoz). De acuerdo con algunos
de los últimos estudios, parece claro, sin embargo, que este nuevo enfoque puede
estar asociado con algunos trastornos metabólicos importantes en los primeros
días de vida 17.
En particular, la alimentación precoz influencia fuertemente el metabolismo de
potasio, fósforo y calcio, definiendo un síndrome que simula de alguna manera lo
que sucede en condiciones de re-alimentación después de intensas deprivaciones
nutricionales, como el kwashiorkor y en el físico culturismo extremo 18,19.
Por esta razón, Mizumoto también utilizó la definición de síndrome de
realimentación para esta condición del prematuro 8.
Las alteraciones observadas no son ninguna sorpresa para el investigador. De hecho, potasio y fósforo son los principales iones presentes en el citoplasma, respectivamente, con carga positiva y negativa. Además, el fósforo es un componente significativo de los ácidos nucleicos, ATP y fosfolípidos de membrana. El suministro de cantidades adecuadas de nitrógeno, potasio y fósforo es la condición necesaria para obtener un rápido crecimiento celular . Además, la variabilidad de las relaciones proporciones entre estos nutrientes será capaz de modular la calidad del crecimiento 20.
En el recién nacido humano las células de rápido crecimiento necesitarán grandes cantidades de AA y potasio por lo que podemos estimar que las necesidades de este catión están estrechamente relacionadas con el aporte de AA. En un informe anterior se mostró que el balance de potasio se asemeja mucho al del nitrógeno 11.
Al considerar el metabolismo del fósforo, es importante tener en cuenta que éste entra en la constitución de los tejidos blandos. La relación fósforo a nitrógeno en las células no es estable y aumenta en los tejidos en crecimiento rápido [14,15].
Una gran cantidad de este anión también se deposita en el hueso en una proporción fija con el ion calcio y puede actuar como un depósito mineral. De hecho, independientemente del status metabólico óseo adecuado, el consumo de fósforo por la célula es privilegiado en el recién nacido en crecimiento y el ion puede ser liberado a la circulación desde el hueso si fuera necesario para los requerimientos celulares. Cuando el fósforo es absorbido por las células, sin ser aportado adecuadamente por la nutrición administrada, el nivel en sangre cae lo cual puede desencadenar la liberación de fósforo desde el hueso. Simultáneamente, la movilización de calcio causa exceso de calcio en el espacio extracelular lo cual puede causar hipercalcemia y hipercalciuria. El calcio perdido se encontrará en exceso en el espacio extracelular (riesgo de hipercalcemia) y estimulará su excreción urinaria 21.
La estricta relación entre aporte de AA, calcio y fósforo no es específica para los primeros días de vida de los recién nacidos alimentados por vía parenteral. Este fenómeno de deprivación de fósforo también se puede observar en recién nacidos prematuros alimentados por vía enteral cuando una suplementación de proteína no se acompaña por una modificación de la relación Ca / P. La relación entre retención de fósforo, y tanto la retención de nitrógeno como de calcio se ha evaluado anteriormente en nutrición enteral utilizando técnicas de balance metabólico 22,23.
Por lo tanto, la asociación de hipokalemia, hipercalcemia e hipofosfatemia puede efectivamente describir un nuevo síndrome en niños prematuros, vinculado a la nutrición parenteral agresiva precoz. Sin embargo, no puede adecuadamente ser considerado como un síndrome de "re-alimentación". De hecho, antes de la "era de la alimentación precoz" algunas alteraciones metabólicas bien conocidas, tales como hipocalcemia, hipoglucemia, hiperpotasemia no oligúrica e hiperfosfatemia, reflejo del estado catabólico, ya representaban un síndrome neonatal relacionado con el nacimiento y la interrupción del continuo flujo placentario nutricional que podríamos llamar : síndrome de Alimentación placentaria Interrumpida del recién nacido prematuro (síndrome PI Feeding) (Figura 4).
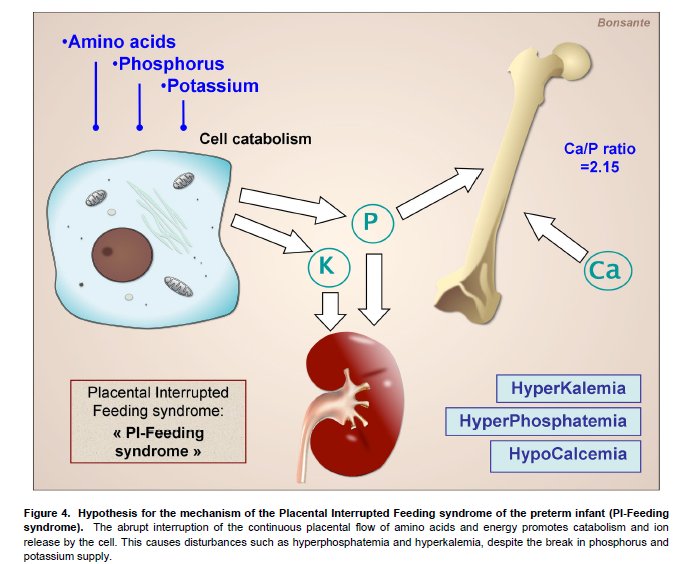
Las perturbaciones que observamos ahora no están relacionados con un fenómeno de realimentación sino que con una provisión subóptima de nutrientes después de la interrupción de alimentación placentaria, dado que la restauración de un flujo continuo de AA y la energía no está acompañada por el aporte de todos los otros nutrientes. Por tanto proponemos definir esta condición como : síndrome de alimentación placentaria incompletamente restaurada (síndrome PI -realimentación) (Figura 5).

Consideraciones acerca del cálculo teórico de requerimientos de Fósforo
El intento de calcular el requerimiento ideal de fósforo en el prematuro es quizás una misión imposible. De hecho, nuestros datos sobre las necesidades específicas tisulares sobre óptimo contenido de fósforo del hueso y sobre el patrón de crecimiento ideal son incompletos; amplias variaciones pueden ser hipotetizadas según la edad gestacional, edad postnatal y dependiendo de variaciones individuales. Además, la tolerancia y la estabilidad del fósforo en las bolsas de nutrición parenteral limitan nuestras posibilidades. Sin embargo, el fósforo está presente en los tejidos con proporciones algo fijas en comparación con otros constituyentes esenciales, lo que permite un cálculo correcto de los desequilibrios predecibles.
Nuestro objetivo era, por tanto, estimar en base a aportes definidos de AA y Calcio, siempre decididas arbitrariamente, el suministro óptimo de fósforo, con el fin de minimizar el riesgo de trastornos metabólicos agudos. debe tenerse precaución en relación con la estabilidad de la solución de NP. En nuestra población la alimentación enteral fué limitada durante la primera semana de vida. Por esta razón hemos elaborado la fórmula sin tener en cuenta la tasa de absorción intestinal de nutrientes que pueden variar ampliamente en el recién nacido prematuro. Esto tiene que ser considerado como una limitación de este estudio. El algoritmo propuesto necesita ser validado en un estudio prospectivo.
Conclusión
El presente estudio añade más evidencia a los conocimientos actuales, subrayando el riesgo de alteraciones electrolíticas durante la nutrición parenteral "agresiva" precoz en el recién nacido prematuro. Como ya se ha observado por nosotros y otros autores, este riesgo de perturbaciones sistemáticas puede describir un síndrome debido a la alimentación incompleta después de la interrupción del flujo de nutrientes a través de la placenta, el síndrome de PI-realimentación. El esfuerzo para mejorar la nutrición de los prematuros ha llevado a muchos de nosotros a centrarse principalmente en la cantidad de aporte de AA y de energía, subestimando en parte el rol fundamental de fósforo y potasio para el crecimiento.
Este paper intenta un enfoque práctico para calcular la cantidad de fósforo a ser añadida en la bolsa de NP , aunque sin tratar de proporcionar el aporte ideal , sino más bien con el objetivo de evitar perturbaciones graves en las concentraciones plasmáticas de calcio y fosfato.