
Insuficiencia suprarenal relativa en el Prematuro
Junio 2022
Insuficiencia suprarenal relativa en el Prematuro
Cristina E. Gutierrez, MD,* Theodore
De Beritto, MD, MS*
*Division of Neonatology, Department
of Pediatrics, Mattel Children’s Hospital, David Geffen School of Medicine at
UCLA, Los Angeles, CA
Brechas educativas
Se ha investigado e identificado la insuficiencia suprarrenal relativa en el prematuro con sepsis.
Se necesita más investigación para determinar si los corticosteroides deben usarse como tratamiento de primera línea en neonatos con sospecha de insuficiencia suprarrenal relativa.
Se necesitan más estudios a largo plazo para caracterizar los valores normales de cortisol en prematuros.
Objetivos
Después de completar este artículo, los lectores deberían poder:
Definir insuficiencia suprarrenal relativa
Reconocer las diferentes zonas de las suprarrenales y su función
Identificar hormonas claves producidas por las glándulas suprarrenales
Evaluar las barreras específicas para identificar y tratar la insuficiencia suprarrenal en el recién nacido prematuro
Abstract
La identificación de insuficiencia suprarrenal relativa en el recién nacido prematuro gravemente enfermo no siempre es clara.
Los recién nacidos prematuros con shock resistente a vasopresores pueden tener insuficiencia cardiovascular persistente, lo que puede causar una rápida descompensación.
Después de los intentos de reanimación con líquidos e inotrópicos, a menudo se encuentra que estos bebés responden a los glucocorticoides.
Esto plantea la importante pregunta de la prevalencia de la insuficiencia suprarrenal en la población de prematuros.
Este artículo revisa el desarrollo y el papel de las glándulas suprarrenales, define la insuficiencia suprarrenal relativa en la población de prematuros, analiza las barreras para determinar este diagnóstico y describe las opciones de tratamiento.
Abreviaturas
ACTH adrenocorticotropic hormone
CRH corticotropin-releasing hormone
DHEA dehydroepiandrosterone
HPA hypothalamic-pituitary-adrenal
PDA patent ductus arteriosus
3β-HSD : 3-β dehydrogenase
11β-HSD1 : 11-β hydroxysteroiddehydrogenase type 1
11β- HSD2 : 11-β hydroxysteroid dehydrogenase type 2
Introducción
Cuando se trata a bebés en la UCIN, los médicos a menudo se enfrentan a cuestiones complejas y problemas multifactoriales.
Esto es especialmente cierto cuando se diagnostica sepsis en prematuros o con bajo peso al nacer.
Cuando los recién nacidos prematuros desarrollan insuficiencia cardiovascular que no se resuelve con soporte de líquidos e inotrópicos, es importante considerar la insuficiencia suprarrenal relativa como causa principal para que se pueda proporcionar el tratamiento adecuado.
La insuficiencia suprarrenal no tratada puede ser perjudicial para la respuesta de los bebés ante cualquier factor estresante, en particular la sepsis.
En esta revisión, describiremos el desarrollo embriológico y posnatal de las glándulas suprarrenales.
Además, analizaremos el eje hipotálamo-pituitario-suprarrenal (HPA) y las hormonas producidas dentro de este sistema, así como las funciones críticas que desempeñan.
Exploraremos la importancia de reconocer y diagnosticar la insuficiencia suprarrenal relativa en el prematuro y discutiremos su impacto en la población de prematuros, específicamente en la sepsis neonatal.
Por último, resumiremos las prácticas diagnósticas más actuales para determinar la insuficiencia suprarrenal relativa en el recién nacido prematuro, así como tambien las opciones de tratamiento.
Sepsis en el Prematuro
Los prematuros con sepsis
de inicio temprano (que ocurre antes de las 48 a 72 horas de vida) o sepsis de
inicio tardío (que ocurre después de las 48 a 72 horas de vida) generalmente se
presentan con mala alimentación, inestabilidad de temperatura, dificultad
respiratoria y letargo. Aunque los antibióticos son una parte importante del
tratamiento de la sepsis, los bebés afectados también deben ser monitoreados para
insuficiencia cardiovascular, la cual debe tratarse de manera rápida y efectiva. En
recién nacidos a término y niños, las guías de sepsis de 2020 establecidas en la
Campaña Sobrevivir a la Sepsis recomiendan bolos de líquidos en casos de shock y
continuar el tratamiento con inotrópicos si el control de la presión
arterial se mantiene
refractario a los fluidos. (1) Sin embargo, actualmente no existen guías para el
manejo de la sepsis en el recién nacido prematuro, ya que no se han realizado
estudios a gran escala para abordar el manejo más efectivo en esta población.
En la práctica clínica, los recién nacidos prematuros con shock séptico
generalmente se tratan de manera similar, primero con reanimación con líquidos
y, si el shock persiste, luego con dopamina, norepinefrina o epinefrina. (2) Sin
embargo, la reanimación con líquidos en esta población debe usarse con prudencia
porque la administración excesiva de líquidos puede exacerbar la enfermedad
pulmonar crónica, retrasar el cierre del conducto arterioso permeable (DAP),
aumentar el riesgo de hemorragia intraventricular y, lo que es más importante,
aumentar el riesgo de mortalidad. (3) Los prematuros con shock séptico
también difieren de sus contrapartes a término en su respuesta al estrés. Las
glándulas suprarrenales de los recién nacidos a término con estrés inducido por
sepsis liberan una cantidad adecuada de cortisol; sin embargo, algunos bebés
prematuros no pueden generar una respuesta adecuada correspondiente a la
gravedad de la enfermedad, lo que se conoce como “insuficiencia suprarrenal
relativa”. (4) Si este diagnóstico no se reconoce en los bebés prematuros
afectados con shock, estos bebés pueden tener consecuencias sistémicas y
muerte potencial.
Hipotensión y Shock
La presión arterial normal en los recién
nacidos prematuros es muy variable debido a la heterogeneidad de la población y
no existe un rango normal bien definido para las diferentes edades
posmenstruales. La definición más ampliamente aceptada para una presión arterial
media normal en esta población es de 2 a 3 mm Hg por encima de la edad
posmenstrual del neonato en semanas. (3) Aunque los términos “hipotensión” y
“shock” a menudo se usan indistintamente, estos diagnósticos son distintos. La
hipotensión se define como una presión arterial baja en comparación con un valor
normal basado en la edad gestacional y cronológica. Por el contrario, el shock
se define como una perfusión inadecuada del tejido del órgano. (2)
Muchos mecanismos fisiopatológicos de la hipotensión se encuentran en los recién
nacidos prematuros con sepsis. Los lactantes afectados tienen una contractilidad
cardíaca alterada, así como tambien un volumen intravascular reducido. Tanto los recién
nacidos a término como los prematuros pueden experimentar vasodilatación, fuga
capilar y pérdidas de líquidos que conducen a un shock. (2) Sin embargo, debido
a que el corazón del prematuro tiene un miocardio inmaduro, el
prematuro responde menos a las catecolaminas endógenas y exógenas, lo que
dificulta el tratamiento de la hipotensión. (3) Además, muchos bebés prematuros
tienen un DAP , lo que puede contribuir aún más a la disminución del gasto
cardíaco como resultado del run-off diastólico. Esta constelación puede conducir
a la incapacidad de suministrar suficiente oxígeno a los tejidos, lo que provoca
un shock.
Aunque la insuficiencia cardiovascular
contribuye en gran medida al declive neonatal durante los períodos de estrés, es
importante considerar otros factores contribuyentes que podrían impedir una
respuesta adecuada del cortisol, tal como el desarrollo inmaduro de las glándulas
suprarrenales. Un estudio demostró que los prematuros que recibieron
terapia inotrópica tenían niveles de cortisol más bajos que los que no la
recibieron, lo que indica un ruptura a lo largo del eje HPA. (4) Esto podría
deberse a innumerables razones, incluyendo supresión de citoquinas de la
síntesis de cortisol o de la liberación de hormona adrenocorticotrópica (ACTH),
respuesta cortical suprarrenal limitada a la ACTH producida o perfusión
insuficiente de las glándulas suprarrenales. (5) Esta falta de cortisol
circulante puede proporcionar una idea del manejo del shock secundario a
sepsis.
Desarrollo de las glándulas suprarenales
Los pasos iniciales del desarrollo de la
corteza suprarrenal ocurren durante la semana 4 de gestación cuando el epitelio
celómico se espesa. (6) Las células del epitelio luego invaden el mesénquima y
las más mediales de estas células forman el primordio suprarrenal
aproximadamente 33 días después de la concepción. Luego, la glándula se
diferencia en la corteza suprarrenal, así como tambien en la zona fetal (la zona más
interna) y la zona definitiva. Esto ocurre a los 50 a 52 días después de la
concepción. En este momento, la zona fetal está produciendo altos niveles de
enzimas esteroidogénicas. A las 9 semanas de gestación, la glándula suprarrenal
está vascularizada y se forma la cápsula mesenquimatosa. (6)
La médula suprarrenal se desarrolla al mismo tiempo que la corteza, pero
deriva de las células de la cresta neural. (6) Al formar la médula, las células
invaden ventralmente el esclerotomo anterior y la aorta dorsal. En este punto,
ahora es de linaje simpaticoadrenal y puede comenzar a producir células
progenitoras neuronales catecolaminérgicas. Algunas de estas células viajan
desde la aorta dorsal hasta el primordio suprarrenal y se convierten en células
cromafines que se encuentran dispersas por toda la corteza suprarrenal. (6)
Además de la médula, los principales componentes de la glándula suprarrenal madura son la zona reticularis, la zona fasciculada y la zona glomerulosa. Sin embargo, en las primeras etapas de desarrollo, estas secciones se conocen como zona fetal, zona de transición y zona definitiva, respectivamente. (6) Cuando un feto alcanza el desarrollo a término, la zona fetal es la que más contribuye al tamaño de la glándula suprarrenal.
La zona fetal produce la mayoría de las
enzimas esteroidogénicas durante este período de desarrollo temprano. Esta zona
involuciona después del nacimiento, lo que da como resultado una disminución del
50% en el tamaño de las glándulas suprarrenales a las 2 semanas de edad, así
como tambien una disminución en la producción de andrógenos. Su sucesora, la zona reticularis, comienza a formarse alrededor de los 3 a 6 años de edad, momento en
el que se reinicia la producción de andrógenos suprarrenales. La zona de
transición produce cortisol y se convierte lentamente en la zona fasciculada a
los 3 años de edad, mientras que la zona definitiva se convierte en la zona
glomerulosa. (6) En el desarrollo temprano, la zona fasciculada sintetiza
cortisol en respuesta a la ACTH de la hipófisis (en respuesta a la hormona
liberadora de corticotropina [CRH] del hipotálamo). (4)
Eje HPA materno fetal
Se deben considerar tres componentes
principales en el desarrollo fetal del eje HPA: la mujer embarazada, la placenta
y el feto. (7) El cortisol inicialmente puede pasar a través de la placenta de
la mujer embarazada, lo cual suprime la producción de cortisol fetal a través de
la retroalimentación negativa (feedback) del eje HPA fetal. La placenta actúa como un
guardián para que el cortisol materno acceda a la placenta a través de la enzima
11-b hidroxiesteroide deshidrogenasa tipo 2 (11b-HSD2). Esta enzima oxida el
cortisol materno a cortisona inactiva; sin embargo, al principio del desarrollo
fetal, la actividad de esta enzima es muy baja y el cortisol materno puede
ejercer una retroalimentación negativa sobre el eje HPA fetal. (7) Por lo tanto,
el eje HPA fetal está suprimido durante la gestación temprana y el cortisol materno
es la principal fuente de esteroides a los que está expuesto el feto (Figura 1).

Figura 1
En la gestación temprana, el cortisol materno
que pasa a través de la placenta inhibe la producción de hormona liberadora de
corticotropina (CRH) por parte del hipotálamo fetal, así como tambien la producción de
hormona adrenocorticotrópica (ACTH) por parte de la glándula pituitaria fetal.
De esta manera, la producción de cortisol fetal se inhibe hasta cerca del desarrollo
a término.
En la placenta, hay una marcada producción de CRH, y la producción más alta
ocurre cerca del término; esta CRH placentaria se encuentra tanto en la
circulación materna como fetal. (7) Antes de las 30 semanas de gestación, la
progesterona de la placenta pasa por alto (bypasea) la 3-b deshidrogenasa (3b-HSD) para
producir cortisol. (4) Hay 3b-HSD limitada en la gestación temprana y el feto no
sintetiza cortisol de novo hasta las 30 semanas de gestación. (4)
La actividad de 11b-HSD2 aumenta en el tercer trimestre, disminuyendo la
cantidad de cortisol materno presente en su forma activa, lo que estimula al
feto a comenzar a producir su propia ACTH y cortisol fetal. (7) Al final de la
gestación, el cortisol materno ya no predomina en el feto; cuando esto ocurre,
aumentan la síntesis de ACTH y la producción de cortisol fetal (Figura 2). (7)
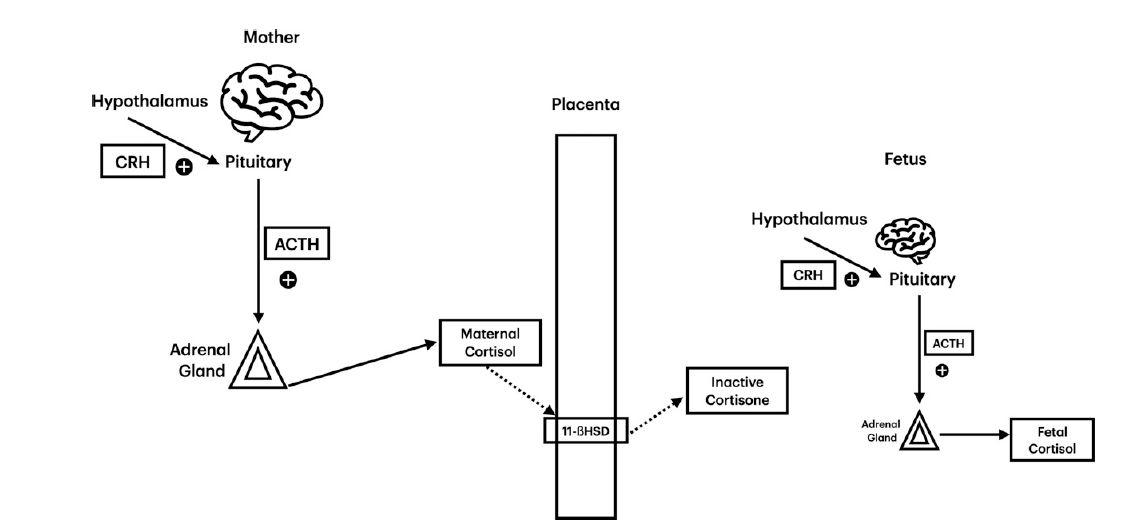
Figura 2
A diferencia de la gestación temprana, en la gestación tardía hay mayor
presencia de 11-b hidroxiesteroide deshidrogenasa (11b-HSD) en la placenta.
El cortisol materno activo se transforma en cortisona inactiva por esta enzima.
Como resultado, el eje hipotálamo-pituitario-suprarrenal fetal ahora puede
producir
cortisol fetal sin inhibición.
Los bebés prematuros se están perdiendo estos pasos clave del desarrollo de la producción de cortisol, lo que posteriormente contribuye a su mala regulación hemodinámica en momentos de estrés y su incapacidad para generar una respuesta adecuada al estrés. Al examinar de cerca el desarrollo embriológico de las glándulas suprarrenales, se pueden comprender mejor las diferencias entre los bebés prematuros y los nacidos a término a medida que desarrollan sus respectivas respuestas al estrés.
Hormonas producidas por las glándulas y sus roles
Zona Fasciculata
El cortisol se forma en la corteza
suprarrenal a partir del colesterol almacenado en la zona fasciculada en
respuesta a la ACTH. El cortisol producido puede unirse a la albúmina o a la
globulina transportadora de corticosteroides. El cortisol inactivo puede
activarse a través de la 11-b hidroxiesteroide deshidrogenasa tipo 1 (11b-HSD1)
y reconvertirse mediante 11b-HSD2 tanto en el páncreas como en el riñón. (8) El
cortisol es una hormona multifuncional que regula el metabolismo, la respuesta
al estrés, la función inmunológica y la respuesta inflamatoria. (8)
En situaciones de estrés, la amígdala procesa los estímulos emocionales y envía
un mensaje al hipotálamo para activar el sistema nervioso simpático. Esto induce
a las glándulas suprarrenales a liberar catecolaminas. (8) Inicialmente, se
libera epinefrina y, si la respuesta al estrés persiste, el hipotálamo provoca
la liberación de cortisol desde la corteza suprarrenal a través del eje HPA. (8)
El cortisol aumenta la disponibilidad de
glucosa en sangre para el cerebro a través de la gluconeogénesis en el hígado,
el páncreas, el tejido adiposo y el músculo. (8) También aumenta la actividad
del glucagón, las catecolaminas y la epinefrina. En condiciones no estresantes,
el cortisol permanece unido a proteínas a la albúmina oa la globulina
transportadora de cortisol. Cuando se libera cortisol y se une a los receptores
de glucocorticoides, puede tener un impacto directo en la eficacia de las
catecolaminas, ya que inhibe la descomposición de los receptores b y promueve su
densidad. (4) De esta forma, el cortisol promueve la estabilidad hemodinámica.
Dos consecuencias clínicas primarias de la producción insuficiente de cortisol
en el recién nacido prematuro son la enfermedad pulmonar crónica y la
inestabilidad cardiovascular. El cortisol ayuda a suprimir la inflamación en las
vías respiratorias en desarrollo; sin esto, la inflamación puede descontrolarse
y aumentar la probabilidad de desarrollar displasia broncopulmonar. La
inestabilidad cardiovascular relacionada con la falta de cortisol puede provocar
hipotensión que responde mal a los vasopresores y tiene el potencial de colapso
cardiovascular eventual. (9)
Zona Glomerulosa
La aldosterona es un mineralocorticoide
producido en la zona glomerulosa. Cuando se libera, los riñones absorben sodio y
excretan potasio. La aldosterona ayuda a controlar la presión arterial
aumentando o disminuyendo el volumen de líquido extracelular a través de la
regulación del sodio. (10) Esta hormona también ayuda a regular el pH en el
cuerpo, ya que los iones de hidrógeno se eliminan a través del intercambio con
potasio en el lumen de la nefrona. (10)
Aunque se adapta bien a los recién nacidos
a término, el intercambio de iones de potasio por iones de hidrógeno puede
provocar alcalosis, lo cual se produce con más frecuencia en los recién nacidos
prematuros debido a la inmadurez de los riñones. (10) La hiponatremia es otra
secuela relacionada con la disminución de la capacidad de respuesta a la
aldosterona en el túbulo renal distal y tiene el potencial de contribuir al
compromiso circulatorio a través de un volumen intravascular bajo. (9)
Zona Reticularis
La dehidroepiandrosterona (DHEA) y los
esteroides androgénicos son producidos por la zona reticularis. Estas hormonas
sirven como precursores de los estrógenos y andrógenos y son hormonas masculinas
débiles. DHEA también contribuye a reducir la inflamación, mejorar el flujo
sanguíneo, la inmunidad celular, la sensibilidad a la insulina y el metabolismo
óseo. (11) La DHEA se produce principalmente en la zona fetal antes de que
involucione. (12) La DHEA es sulfatada en las glándulas suprarrenales para
formar DHEA-S, que promueve la producción adicional de 11b-HSD2 de la placenta.
(7) Los niveles más altos de 11b-HSD2 fomentan la producción de cortisol fetal.
(7)
Médula adrenal
La adrenalina y la noradrenalina se
producen en la médula suprarrenal y son liberadas por las células cromafines. La
norepinefrina, el precursor de la epinefrina, aumenta la contractilidad del
corazón, aumenta la frecuencia cardíaca y mejora el tono vascular. En pequeñas
dosis, la epinefrina aumenta la liberación de renina, mejora la contractilidad
cardiovascular, aumenta la frecuencia cardíaca y tiene un efecto sobre la
broncodilatación. (13) En grandes dosis, la epinefrina puede causar dilatación
pupilar, contracción del músculo liso vascular y contracción del músculo del
esfínter intestinal. (13) Las catecolaminas se liberan en casos de estrés agudo
y es probable que se eleven durante la sepsis en recién nacidos a término. La
médula suprarrenal no está completamente desarrollada en los bebés prematuros,
lo que disminuye la probabilidad de una respuesta adecuada al estrés y puede
provocar problemas cardiovasculares, problemas de termorregulación y mala
adaptación en la vida extrauterina. (14)
Diagnóstico
El nivel de cortisol sérico es un marcador
clave que es más alto durante los períodos de estrés y enfermedad grave. (4)
Aunque los estudios han determinado niveles normales de cortisol en pacientes
adultos, los valores normales específicos en bebés prematuros han sido objeto de
intensos debates. Sin embargo, sabemos que los bebés prematuros tienen un nivel
más bajo de cortisol circulante en su línea basal. Como resultado, cuando
los bebés prematuros desarrollan sepsis, la hipotensión es más probable debido a
niveles inadecuados de cortisol. En este escenario, la administración de
glucocorticoides a menudo mejorará la presión arterial del bebé. (15) Estudios
previos de ultrasonido que analizan el tamaño suprarrenal como predictor de
insuficiencia suprarrenal han observado que las suprarrenales inmaduras que no
experimentan un cambio involutivo 3 semanas después del nacimiento tienen riesgo
de insuficiencia suprarrenal. (9)
Dada la falta general de consenso sobre los criterios de diagnóstico y el cuadro
multifactorial del estrés en esta población, la insuficiencia suprarrenal
relativa es difícil de diagnosticar en el recién nacido prematuro. Sin embargo,
en un recién nacido prematuro con sepsis que tiene hipotensión resistente a los
vasopresores o cirugía reciente, la insuficiencia suprarrenal relativa debe
estar en el diferencial. (16) También se debe considerar la insuficiencia
suprarrenal relativa en bebés nacidos de madres que recibieron esteroides
prenatales recientemente, ya que esto puede suprimir la función suprarrenal
posnatal en el recién nacido. (9) Los neonatos afectados pueden presentar
oliguria, hiperpotasemia e hiponatremia que típicamente no mejoran con la
expansión de volumen. (9) La obtención de los niveles de cortisol no suele ser
útil en este escenario, ya que los resultados no están disponibles rápidamente y
los valores normales no se conocen, por lo que el tratamiento a menudo se busca
basándose únicamente en la sospecha.
Tratamiento y Outcomes
El paso inicial en el tratamiento del
shock es la reanimación con líquidos y el posterior inicio de vasopresores. Si
los signos de shock no se resuelven, es apropiado considerar insuficiencia
suprarrenal relativa y administrar terapia con glucocorticoides. Es importante
tener en cuenta que, al nacer, los bebés prematuros tienen un número limitado de
receptores ala , un miocardio inmaduro, menos receptores Beta y menos reserva corticosuprarrenal en comparación con los pacientes mayores. (2)
Los glucocorticoides ayudan a promover la expresión de los receptores adrenérgicos
cardíacos, mejorando así el gasto cardíaco. (9) Un estudio examinó a recién
nacidos prematuros de muy bajo peso al nacer que tenían hipotensión refractaria
incluso después de haber sido tratados inicialmente con líquidos y dopamina. (2)
En este estudio, 1 grupo también recibió hidrocortisona, en comparación con un
grupo de control que solo recibió líquido y dopamina. El grupo que recibió
hidrocortisona tuvo una recuperación más rápida de la presión arterial; sin
embargo, no hubo diferencia en el resultado clínico entre los 2 grupos. (2) Un
factor importante a reconocer es que la administración de glucocorticoides, como
dexametasona e hidrocortisona, puede suprimir la función HPA del recién nacido;
sin embargo, la recuperación se puede ver de 1 a 2 meses después de la
administración, por lo que estos medicamentos no deben evitarse si son
necesarios. (12)
Hay mucho debate sobre el tipo de esteroide que se debe usar para tratar a
los bebés con insuficiencia suprarrenal relativa. En el estudio PREMILOC de 2016
que comparó dexametasona, hidrocortisona y placebo para prevenir la displasia
broncopulmonar, se favoreció el uso de hidrocortisona sobre la dexametasona,
porque la hidrocortisona tiene un efecto menor sobre el crecimiento y el
neurodesarrollo e influye tanto en los mineralocorticoides como en los
glucocorticoides. (17) Aunque la hidrocortisona puede mejorar la inestabilidad
hemodinámica, puede asociarse con perforación gastrointestinal en recién nacidos
prematuros que reciben indometacina para el cierre del DAP, por lo que debe
evitarse en este grupo. (18)
También se ha estudiado el uso de
esteroides como medicación de primera línea en recién nacidos prematuros con
signos de insuficiencia suprarrenal relativa. Los 5 estudios realizados en
recién nacidos prematuros con un promedio de 23 a 29 semanas de edad gestacional
estaban evaluando si el tratamiento profiláctico de la insuficiencia suprarrenal
mejoraría los outcomes o resultados asociados, tal como la displasia broncopulmonar. (19) Estos
estudios finalmente mostraron resultados más altos de cortisol sérico en bebés
que recibieron profilaxis con hidrocortisona en comparación con el grupo de
control, que no recibió glucocorticoides, así como tambien menores probabilidades de
displasia broncopulmonar. (19)
Conclusión
En el recién nacido prematuro, es
importante monitorear todos los hallazgos clínicos de suficiencia circulatoria,
incluyendo la presión arterial, la frecuencia cardíaca y la diuresis. Es difícil
evaluar la causa del compromiso cardiovascular en esta población, ya que estamos
limitados por la falta de guías clínicas estandarizadas de presión arterial y rangos
normales de niveles de cortisol. Además, el uso de control del dolor en la
población de prematuros puede amortiguar la respuesta del bebé al estrés y la
regulación de la presión arterial al disminuir la cantidad de hormona del estrés
presente. (12) Muchos factores pueden contribuir a la insuficiencia suprarrenal
en el recién nacido prematuro, incluyendo glándulas suprarrenales inmaduras,
disminución de respuesta a la CRH y la capacidad disminuida para producir cortisol. Los
neonatos que presentan shock que no responde a la reanimación con
líquidos o vasopresores deben considerarse candidatos para la hidrocortisona;
sin embargo, se debe tener cuidado para evitar este medicamento en poblaciones
de alto riesgo, particularmente en bebés que reciben tratamiento para un DAP.
Dada la respuesta deficiente a los
líquidos e inotrópicos en el recién nacido prematuro con insuficiencia
suprarrenal, existe la oportunidad de estudiar más a fondo si la administración
de corticosteroides sería el tratamiento de primera línea más eficaz para los
recién nacidos prematuros con shock. Al comprender las limitaciones de las
glándulas suprarrenales de los prematuros, así como los signos y síntomas
clínicos de la insuficiencia suprarrenal relativa, podemos aspirar a brindar a
los bebés que tienen insuficiencia suprarrenal relativa la intervención rápida y
el apoyo que necesitan, en un esfuerzo por producir el mejores resultados.
American Board of Pediatrics Neonatal-Perinatal Content Specification
Conocer la fisiopatología de un recién nacido a término o prematuro con una condición que afecta la presión arterial sistémica, tal como hipotensión o hipertensión
Referencias
Weiss SL, Peters MJ, Alhazzani W, et al. Surviving sepsis campaign international guidelines for the management of septic shock and sepsis-associated organ dysfunction in children. Pediatr Crit Care Med. 2020;21(2):e52–e106
Barrington KJ. Hypotension and shock in the preterm infant. Semin Fetal Neonatal Med. 2008;13(1):16–23
Schwarz CE, Dempsey EM. Management of neonatal hypotension and shock. Semin Fetal Neonatal Med. 2020;25(5):101121
Fernandez EF, Watterberg KL. Relative adrenal insufficiency in the preterm and term infant. J Perinatol. 2009;29(Suppl 2):S44–S49
Watterberg KL. Adrenal insufficiency and cardiac dysfunction in the preterm infant. Pediatr Res. 2002;51(4):422–424
Yates R, Katugampola H, Cavlan D, et al. Adrenocortical development, maintenance, and disease. Curr Top Dev Biol. 2013;106:239–312
Watterberg KL. Adrenocortical function and dysfunction in the fetus and neonate. Semin Neonatol. 2004;9(1):13–21
Thau L, Gandhi J, Sharma S. Physiology, cortisol. In: StatPearls [Internet]. Treasure Island, FL: StatPearls Publishing; 2021. https://www.ncbi.nlm.nih.gov/books/NBK538239/. Accessed February 1, 2022
Iijima S. Late-onset glucocorticoid-responsive circulatory collapse in premature infants. Pediatr Neonatol. 2019;60(6):603–610
Scott JH, Menouar MA, Dunn RJ. Physiology, aldosterone. In:StatPearls [Internet]. Treasure Island, FL: StatPearls Publishing; 2021. https://www.ncbi.nlm.nih.gov/books/NBK470339/. Accessed February 1, 2022
Traish AM, Kang HP, Saad F, Guay AT. Dehydroepiandrosterone (DHEA)–a precursor steroid or an active hormone in human physiology. J SexMed. 2011;8(11):2960–2982, quiz 2983
Ng PC. The fetal and neonatal hypothalamic-pituitary-adrenal axis. Arch Dis Child Fetal Neonatal Ed. 2000;82(3):F250–F254
Dalal R, Grujic D. Epinephrine. In: StatPearls [Internet]. Treasure Island, FL: StatPearls Publishing; 2021. https://www.ncbi.nlm.nih.gov/books/NBK482160/.
Ramalho FS. Development and function of the adrenal cortex and medulla in the fetus and neonate. In: Kovacs CS, Deal CL, eds. Maternal-Fetal and Neonatal Endocrinology: Physiology, Pathophysiology, and Clinical Management. Philadelphia, PA: Academic Press; 2019; chap 36:611–623
Chung HR. Adrenal and thyroid function in the fetus and preterm infant. Korean J Pediatr. 2014;57(10):425–433
Yi git S¸, T€urkmen M, Tuncer O, et al. Neonatal adrenal insufficiency: Turkish Neonatal and Pediatric Endocrinology and Diabetes Societies consensus report. Turk Pediatri Ars. 2018;53(suppl 1): S239–S243
Htun ZT, Schulz EV, Desai RK, et al. Postnatal steroid management in preterm infants with evolving bronchopulmonary dysplasia. J Perinatol. 2021;41(8):1783–1796
Gupta S, Prasanth K, Chen CM, Yeh TF. Postnatal corticosteroids for prevention and treatment of chronic lung disease in the preterm newborn. Int J Pediatr. 2012;2012:315642
Shaffer ML, Baud O, Lacaze-Masmonteil T, Peltoniemi OM, Bonsante F, Watterberg KL. Effect of prophylaxis for early adrenal insufficiency using low-dose hydrocortisone in very preterm infants: an individual patient data meta-analysis. J Pediatr. 2019;207(e5): 136–142.e5